Артериальное давление (АД) при физиологической беременности обычно снижается. Вследствие уменьшения периферической сосудистой резистентности АД снижается во второй половине I триместра беременности и достигает наименьшего уровня в середине второго триместра. В течение III триместра АД обычно повышается, но он не должен быть выше, чем до беременности.
- Преэклампсия
- Острая жировая дистрофия печени
- Эклампсия
- Хроническая гипертензия
- Преэклампсия, соединенная с хронической гипертензией
Классификация. Гипертензия может существовать до беременности (хроническая гипертензия) или быть вызвана беременностью: гестационная гипертензия (ГГ), преэклампсия и эклампсия.
Гипертензивные состояния при беременности
- гестационная гипертензия (гипертензия, вызванная беременностью)
- преэклампсия
- тяжелая преэклампсия
- эклампсия
- хроническая гипертензия
- хроническая гипертензия, осложненная преэклампсией
- острая жировая дистрофия печени
Поражение печени является редким при преэклампсии и ассоциируется с двумя осложнениями с высоким риском заболеваемости и смертности — острой жировой дистрофией печени при беременности. Осложнения гипертензивных расстройств при беременности остаются одной из ведущих причин материнской смертности в развивающихся странах. Учитывая, что патогенетическим лечением этих осложнений является родоразрешение, они также являются ведущей причиной преждевременных родов.
Для определения гипертензивных расстройств при беременности отечественные акушеры-гинекологи используют термин НПГ-гестоз (отеки, протеинурия и гипертензия) и выделяют:
1) моносимптомний гестоз: гипертензию, протеинурию, водянку;
2) преэклампсию (при сочетании любых двух из этих трех симптомов) — легкую, средней тяжести и тяжелую;
3) сочетанные гестозы (на фоне экстрагенитальной патологии — гипертонической болезни, хронических заболеваний почек, сахарного диабета и т.д.);
4) эклампсию.
Почему развивается преэклампсия у беременных?
Самая главная причина таких осложнений — нарушения плацентарной функции, которые закладываются в первые недели беременности, в первом триместре. Тогда и необходимо действовать, чтобы предотвратить осложнения.А на более поздних сроках беременности, доктор уже практически не может изменить ситуацию к лучшему и вынужден делать нелёгкий ввбор между пролонгированием беременности и досрочным родоразрешением.
СМОТРЕТЬ ВИДЕО
Плацента работает как эндокринный орган: она выделяет в кровь некоторые биологически активные вещества, которые нужны для нормального протекания беременности, развития плода. Если этих веществ вырабатывается слишком много, они поступают в кровоток будущей матери и вызывают в ее организме нарушения.
Например, одно из таких веществ – растворимая fms-подобная тирозинкиназа (sFlt-1). Поступая в материнский кровоток, она повышает свертываемость крови, способствует сужению сосудов, повреждает их стенку и усиливает проницаемость. В ходе научных исследований доказано, что повышенный уровень sFlt-1 играет важную роль в развитии преэклампсии.
Существуют и другие теории. Считается, что развитию преэклампсии способствуют: системное воспаление, нарушения работы иммунитета, неспособность сердечно-сосудистой системы женщины адаптироваться к беременности, гестационный диабет, нехватка некоторых питательных веществ, витаминов, минералов.
Чаще всего преэклампсия развивается во время первой беременности у женщин младше 20 и старше 40 лет.
Известны некоторые факторы риска:
- Повышенное артериальное давление во время предыдущих беременностей.
- Ожирение.
- Преэклампсия во время предыдущих беременностей.
- Многоплодная беременность.
- Преэклампсия в анамнезе у близких родственниц: матери, сестры.
- Некоторые заболевания в анамнезе: ревматоидный артрит, системная красная волчанка, сахарный диабет, патологии почек.
Патологические изменения начинаются еще на ранних сроках беременности, но симптомы и осложнения развиваются к её концу (после 20 недели). Когда возникают выраженные проявления, сделать уже практически ничего нельзя. Но в настоящее время существуют исследования, которые помогают выявить риск преэклампсии на ранних сроках и своевременно принять некоторые меры. Поэтому так важно проходить скрининг.
Несмотря на значительные успехи современного акушерства, преэклампсия (ПЭ) является до сих пор одним из наиболее распространенных и тяжелых осложнений беременности [1, 2]. В зависимости от социально-экономического и этнического состава населения она развивается у 5—8% беременных среди популяции [3, 4]. Причем в наибольшей степени ПЭ наблюдается у наиболее здоровой и молодой группы — первобеременных женщин [5]. У повторнорожающих этот процент уменьшается, однако если у таких женщин беременность возникает от нового партнера, то вероятность развития у нее ПЭ увеличивается до значений первобеременных [6]. Феномен этот пока не до конца разгадан. Женщины, у которых ПЭ развилась в первую беременность, сохраняют высокий риск ее развития и в последующих беременностях [6]. Вероятность развития ПЭ также увеличена, если мать или бабушка этой женщины перенесли в свое время такое осложнение [6]. Факт наличия ПЭ у матери отца будущего ребенка тоже увеличивает риск развития ПЭ во время беременности у жены этого человека, что указывает на возможные генетические механизмы такого состояния [7].
Помимо генетических факторов, вероятность развития ПЭ увеличивает следующая патология: артериальная гипертензия до беременности, сахарный диабет, воспалительные заболевания почек, ожирение и гиперкоагуляционные состояния (антифосфолипидный синдром) [8—10]. С увеличением возраста матери (старше 35 лет) вероятность возникновения у нее ПЭ также становится больше [11]. Помимо этого, независимым фактором риска развития ПЭ является многоплодная беременность [12].
Клиническая характеристика беременных с преэклампсией
Основными клиническими признаками ПЭ являются артериальная гипертензия с уровнем диастолического артериального давления более 90 мм рт.ст., протеинурия с суточной потерей белка более 300 мг. Ранее, помимо этих явлений, в так называемую диагностическую триаду вносили отеки. Однако теперь этот признак считают неспецифическим, и поэтому многие исследователи исключили его из числа значимых диагностических. Тем не менее быстрое появление выраженных отеков рук и лица часто заставляет врача предположить наличие ПЭ и более тщательно обследовать пациентку. Преэклампсия чаще всего развивается после 20-й недели беременности, однако в ряде случаев может проявить себя непосредственно перед родами и даже после них.
Показано, что количество потерянного с мочой белка не коррелирует с тяжестью ПЭ [13]. Так, продемонстрировано, что 10% женщин с клиническими проявлениями ПЭ имеют минимальную протеинурию, а у 20% она отсутствует [14]. У многих беременных с ПЭ на фоне снижения гломерулярной фильтрации онкотическое давление плазмы крови оказалось нормальным [15]. Тяжелыми клиническими осложнениями ПЭ могут быть почечная недостаточность, отслойка плаценты, судороги, отек легких, острые повреждения печени, гемолиз и тромбоцитопения. Последние три проявления часто наблюдаются одновременно и составляют так называемый HELLP-синдром [16, 17]. В настоящее время этот синдром рассматривают как тяжелый вариант ПЭ и связывают с высоким риском фатальных исходов для матери и плода [17, 18].
Хотя после родов основная симптоматика ПЭ (гипертензия и протеинурия) быстро исчезает, проведенные в настоящее время эпидемиологические исследования показывают, что это состояние имеет серьезные долговременные последствия для деятельности сердечно-сосудистой системы женщины [19]. Примерно у 20% пациенток, перенесших ПЭ, в течение 7 лет после родов развиваются артериальная гипертензия и микроальбуминурия [19]. С увеличением возраста долгосрочный риск развития сердечно-сосудистой и цереброваскулярной патологии у таких женщин удваивается по сравнению с теми, кто не перенес ПЭ [20]. Показано, что ПЭ является значительным фактором риска развития тяжелой почечной недостаточности, требующей перманентного диализа или трансплантации почки [21]. Как было показано выше, ожирение является фактором риска развития П.Э. При этом сама преэклампсия также выступает как фактор риска последующего развития ожирения, сахарного диабета и метаболического синдрома [22]. Вопрос о том, является ли ПЭ причиной сердечно-сосудистых и метаболических осложнений или предшествующая дисфункция эндотелия определяет как патологическое течение беременности, так и долговременные последствия ПЭ, до сих пор не выяснен.
Патогенез преэклампсии
В прошедшие полтора десятилетия были проведены исследования, значительно расширяющие наши представления о патогенезе ПЭ, в котором центральную роль отдают плаценте. Преэклампсия возникает только при наличии плаценты и разрешается вскоре после ее рождения. При этом оказалось, что наличие плода для развития ПЭ вовсе не обязательно [23]. Детальное исследование наблюдений, когда ПЭ продолжается после рождения ребенка, показало наличие у таких женщин в матке остаточных фрагментов плаценты. Выскабливание, проведенное после этого, сопровождалось быстрым исчезновением симптомов ПЭ [24]. Тяжелые случаи ПЭ сопряжены, как правило, с гипоперфузией или ишемией плаценты. Морфологические исследования плацент родильниц с ПЭ показали наличие острого атероза, очагов некроза, диффузное повреждение и обструкцию сосудов плаценты, утолщение их интимы, отложение в стенке сосудов фибрина и повреждение эндотелия [25]. Частые морфологические находки — инфаркты плаценты в результате окклюзии спиральных артерий [25]. При ультразвуковом исследовании было показано значительное снижение маточно-плацентарного потока крови, предшествующее клиническим проявлениям ПЭ [26]. Морфологические и ультразвуковые изменения коррелировали с тяжестью клинической картины ПЭ [25].
В ходе нормальной плацентации вневорсинчатый плодовый цитотрофобласт осуществляет инвазию в спиральные артерии миометрия. В результате клетки цитотрофобласта замещают эндотелиальные клетки и мышечный слой стенки спиральных артерий, трансформируя их из узких, обладающих высоким сопротивлением сосудов, в широкие сосуды, утрачивающие способность реагировать спазмом на действие вазоактивных агентов [27]. Такое ремоделирование спиральных артерий обеспечивает адекватную перфузию плаценты, способную удовлетворить возрастающие в ходе беременности запросы плода. Показаны недостаточная трансформация и ремоделирование спиральных артерий в ходе развития ПЭ [28, 29]. При этом инвазия цитотрофобласта оказывается существенно лимитирована поверхностными децидуальными клетками, в результате чего сегмент спиральных артерий, проходящий через участок миометрия, предлежащий к плаценте, не претерпевает необходимой трансформации [30]. Существует точка зрения, что при нормальной плацентации клетки цитотрофобласта приобретают свойства эндотелиальных в ходе процесса, носящего название псевдоваскулогенез или васкулярная мимикрия [31]. Это выражается в торможении экспрессии молекул адгезии клеток цитотрофобласта, по своей природе принадлежащих к эпителиальным клеткам, и экспрессии молекул адгезии, характерных для фенотипа клеток эндотелия [31]. При П.Э. не происходит этой замены молекул клеточной поверхности, что и препятствует адекватной инвазии спиральных артерий [32].
Современные исследования [33—35] показывают, что в процессе регуляции развития сосудов плаценты большую роль играют сосудистые эндотелиальные факторы роста (VEGF). Нарушение баланса между про- и антиангиогенными факторами роста имеет большое значение в процессах инвазии цитотрофобласта при ПЭ. У мышей с генетически индуцированным повреждением этих факторов продемонстрированы нарушение плацентарного васкулогенеза и увеличение внутриутробной смертности плодов. Методами иммуногистохимии показаны значительные изменения экспрессии VEGF, плацентарного фактора роста (PlGF) и антиангиогенного фактора (Flt-1) в плацентах женщин с П.Э. Растворимый антиангиогенный фактор (sFlt-1) уменьшает скорость инвазии цитотрофобласта, при этом концентрация его в начале беременности относительно низка, но начинает повышаться в III триместре. Это может отражать завершение васкулогенеза плаценты в конце беременности. Примерно такая же динамика в конце беременности наблюдается в отношении еще одного антиангиогенного фактора — эндоглина.
Хотя плацента, по-видимому, играет значительную каузальную роль в возникновении ПЭ, одним из органов-мишеней является материнский эндотелий [36]. Большое количество плазменных маркеров активации и дисфункции эндотелия находится в состоянии дизрегуляции у женщин с ПЭ, включая антигены Виллебранда, фибронектин, растворимый Е-селектин и эндотелин. Инкубация эндотелиальных клеток в плазме крови, полученной у женщин с ПЭ, приводит к дисфункции этих клеток [33]. Предполагается, что циркулирующие в крови вазоактивные агенты, источником которых является плацента, воздействуют на эндотелий сосудов мозга, почек, сердечно-сосудистой системы матери [36].
Физиологические изменения в организме женщины во время беременности сопровождаются уменьшением периферического сосудистого сопротивления и увеличением сердечного выброса. При П.Э. наблюдается обратная картина: системная вазоконстрикция, увеличение периферического сосудистого сопротивления и снижение сердечного выброса [37]. Более того, при ПЭ увеличивается чувствительность гладких мышечных клеток сосудов к вазопрессорам (ангиотензину II и норадреналину) [38]. У таких женщин снижается реакция эндотелия на вазодилатирующие эндотелиальные факторы [39]. Причем такие реакции наблюдаются раньше клинических симптомов ПЭ в виде артериальной гипертензии и протеинурии [11].
Поражение почек при ПЭ — одно из наиболее ярких проявлений дисфункции эндотелия. Еще в 1959 г. были описаны значительные морфологические изменения гломерулярного аппарата почек, выражающиеся в набухании и вакуолизации эндотелиальных клеток нефронов, отложении фибрина в эндотелии, что породило термин «гломерулярный эндотелиоз» [40]. Электронно-микроскопические исследования показали исчезновение фенестрации гломерулярного эпителия [15]. В отличие от многих заболеваний почек, при ПЭ эндотелиальные клетки нефронов являются первичной мишенью повреждения. Хотя гломерулярный эндотелиоз рассматривается как патогномоничное для ПЭ состояние, начальные проявления этой патологии почечного эндотелия отмечены уже на начальных стадиях ПЭ или индуцированной беременностью артериальной гипертензии [41].
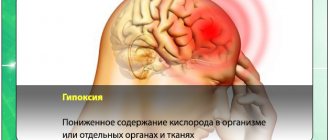
Отек мозга и паренхиматозные геморрагии мозговой ткани являются частой патологоанатомической находкой у женщин, умерших от эклампсии [18]. Однако наличие отека мозга не коррелирует с наличием гипертензии. Вероятно, это указывает на то, что отек мозга скорее всего является результатом дисфункции эндотелия, а не прямого повышения гидростатического давления в мозговых капиллярах [42]. Исследования, проведенные у женщин с ПЭ с помощью компьютерной и магнитно-резонансной томографии, демонстрируют картину, соответствующую гипертензионной энцефалопатии с признаками васкулогенного отека и инфарктов в субкортикальных областях головного мозга [43].
Дисбаланс синтеза про- и антиангиогенных факторов, вероятно, играет ключевую роль в патогенезе П.Э. Увеличение экспрессии растворимой fms-похожей тирозинкиназы 1 (sFlt-1), ассоциированное с ним уменьшение синтеза плацентарного фактора роста и изменение синтеза VEGF являются одними из наиболее ярких признаков нарушения баланса продукции эндотелиальных факторов [44, 45]. VEGF стабилизирует эндотелиальные клетки сосудов и особо важен для поддержания функции эндотелия почек, печени и головного мозга. VEGF взаимодействует с двумя основными рецепторами: Flk и Flt-1. Вариантом мембранно-связанного рецептора к VEGF (его часто обозначают VEGFR1) является sFlt-1, который дает антиангиогенный эффект [46]. Растворимый антиангиогенный фактор sFlt-1 секретируется в основном синцитиотрофобластом в кровоток матери [46]. Фактор sFlt-1 способен связывать как VEGF, так и PlGF и не позволяет этим ростовым факторам взаимодействовать с соответствующими рецепторами [47]. При П.Э. наблюдается увеличение экспрессии sFlt-1, коррелирующее с клиническими проявлениями патологии [48, 49]. В экспериментах in vitro
добавление sFlt-1 в перфузионный раствор вызывает констрикцию сосудов. Экзогенное введение sFlt-1 беременным крысам вызывает развитие синдрома, напоминающего ПЭ с явлениями гипертензии, протеинурии и гломерулярного эндотелиоза [45]. Показано, что подоциты нефронов синтезируют VEGF [50]. При этом фармакологическое блокирование синтеза VEGF у животных вызывает поражение эндотелия нефронов с развитием протеинурии [51]. При экспериментальном гломерулонефрите, вызванном у животных, VEGF является необходимым компонентом для восстановления почечных капилляров и поддержания функции фенестрированного эндотелия [52, 53]. Следует отметить, что фенестрированный эндотелий, помимо нефронов, найден в гепатоцитах печеночных синусов. Печень также является органом-мишенью, поражаемым при П.Э. Таким образом, дефицит синтеза VEGF можно считать одним из важнейших факторов в патогенезе ПЭ.
Физиологическая роль PlGF пока менее понятна, однако этот ростовой фактор стимулирует процессы ангиогенеза в условиях ишемии, воспаления и механического повреждения тканей [54]. PlGF способен усиливать действие VEGF. Моделирование состояния ПЭ у крыс возможно только при ингибировании обоих этих факторов роста [45]. В настоящее время ведется интенсивное изучение ряда других ангиогенных факторов. Так, содержание эндостатина — ингибитора ангиогенеза также увеличено в плазме крови женщин с ПЭ [55]. Еще один антиангиогенный фактор — растворимая форма эндоглина (sEng) — активно синтезируется на начальных этапах развития П.Э. Высокий уровень экспрессии самого эндоглина отмечен в синцитиотрофобласте и цитотрофобласте, участвующих в инвазии спиральных артерий [56]. При П.Э. отмечен высокий уровень синтеза эндоглина [56]. sEng способен усиливать повреждение сосудов, индуцированное sFlt-1 у беременных крыс [33].
До сих пор нет единой точки зрения на то, является ли недостаточная инвазия цитотрофобласта и связанное с ней нарушение ремоделирования спиральных артерий причиной или следствием гипоксии плаценты. Эксперименты на приматах показали, что искусственное стенозирование маточных артерий приводит к гипертензии и протеинурии [57, 58]. Однако в подобных моделях не удалось получить значительных изменений мозгового кровообращения и судорог, а также изменений, похожих на HELLP-синдром [57, 58]. В пользу участия гипоксии плаценты в развитии ПЭ свидетельствует то, что в популяции беременных, проживающих в высокогорных областях, где парциальное давление кислорода во вдыхаемом воздухе существенно ниже, частота ПЭ превышает соответствующий показатель у женщин, живущих на уровне моря, в 2—4 раза [59]. Было показано, что у жительниц высокогорья повышено содержание в плазме крови фактора, индуцируемого при гипоксии плаценты (HIF) [60]. Примерно такое же увеличение содержания этого фактора отмечено в плазме крови у женщин с ПЭ [60]. Было показано, что сам по себе HIF может изменять синтез большого количества про- и антиангиогенных факторов, включая VEGF, PlGF, VEGFR-1 [60]. Кроме того, HIF способен влиять на скорость инвазии цитотрофобласта [61]. Экспериментальная гипоксия плацент мышей стимулирует синтез антиангиогенных факторов [62].
В дополнение ко всему перечисленному при ПЭ наблюдаются изменения активности ренин-ангиотензин-альдостероновой системы (РААС). В ходе развития нормальной беременности синтез всех этих гормонов увеличен [63]. При П.Э. возрастает реакция сосудистой стенки на ангиотензин II и другие вазоконстрикторы [63]. При этом синтез альдостерона у женщин с ПЭ уменьшен [64].
Клинические следствия изучения патогенеза преэклампсии
Хотя к настоящему времени не выработаны единые превентивные и лечебные стратегии в отношении ведения пациенток с ПЭ, клинический опыт указывает на существенный положительный эффект как для матери, так и для плода раннего выявления и мониторирования ПЭ, поддерживающей терапии при этой патологии [2]. Показано, что оценка уровней циркулирующих про- и антиангиогенных факторов позволяет в некоторых случаях за несколько недель прогнозировать наступление ПЭ [65]. В первую очередь это касается оценки концентрации в плазме sFlt-1 и sEng, увеличение которой наблюдается за 5—8 нед до клинического проявления ПЭ [66]. Отношение этих антиангиогенных факторов к концентрации PlGF расценивается как один из лучших маркеров наступления ПЭ [65]. При этом оценку PlGF можно проводить не только в крови, но и в моче [66]. Еще одним потенциально информативным маркером развития ПЭ, является плацентарный протеин-13 (РР13), увеличение концентрации которого может быть зарегистрировано уже в I триместре беременности [67]. Зависимость эта эмпирическая, поскольку патогенетической связи между РР13 и ангиогенными факторами пока не выявлено [67].
Никакого радикального лечения ПЭ, помимо прерывания беременности и удаления из организма женщины плаценты, до сих пор не предложено. Потенциально перспективными представляются идеи лечения ПЭ с помощью синтезированных сосудистых эндотелиальных факторов роста, одним из которых является VEGF-121 [68]. При помощи этого препарата удалось уменьшить артериальную гипертензию и приостановить развитие протеинурии у крыс с ПЭ, моделированной при помощи sFlt1 [68]. Однако пока эти исследования не распространились далее экспериментов на животных. Получены факты о снижении продукции sFlt1 под влиянием статинов в экспериментах на животных [69]. Но клиническое использование статинов в акушерской практике ограничено их потенциальным тератогенным эффектом.
Таким образом, благодаря исследованиям роли про- и антиангиогенных факторов роста наши знания о патогенезе ПЭ существенно расширились. Тем не менее необходимы дальнейшие исследования в направлении поиска информативных маркеров изменения синтеза этих агентов и разработки эффективных способов раннего прогнозирования и мониторирования преэклампсии.
Авторы заявляют об отсутствии конфликта интересов.
Преэклампсия и эклампсия
По данным Минздрава России, преэклампсия и другие осложнения беременности, связанные с повышенным артериальным давлением, занимают четвертое место среди причин материнской смертности в течение последних десяти лет. Преэклампсия – одна из самых распространенных причин преждевременных родов, задержки развития плода, антенатальной гибели плода. Она часто становится показанием к кесареву сечению. Возможные осложнения преэклампсии: отслойка плаценты и мертворождение, инсульт, сердечная недостаточность, отек легких, обратимая слепота, кровотечение в печени, HELLP-синдром, острая почечная недостаточность. Когда уже возникли тяжелые симптомы, единственный способ спасти маму и ребенка – как можно раньше провести оперативное родоразрешение. Но проявления могут сохраняться еще в течение 1–6 недель после того, как ребенок появился на свет.
Даже после родов преэклампсия приводит к серьезным последствиям для здоровья мамы и ребенка. У женщины повышается риск ожирения, артериальной гипертонии, сахарного диабета, ишемической болезни сердца, инсульта. У ребенка повышается риск гормональных, сердечно-сосудистых расстройств, заболеваний, связанных с нарушением обмена веществ.
Опасное осложнение преэклампсии – эклампсия. Это состояние проявляется в виде судорожных припадков, причем, оно может возникать, даже если симптомы преэклампсии выражены слабо или совсем отсутствуют.
Сложно сказать, у кого именно разовьется преэклампсия. Если женщина совершенно здоровая, и у нее нет факторов риска, это еще ни о чем не говорит. Преэклампсия может развиваться у любой женщины во время любой беременности.
Риск развития ПЭ в картинках
Источники
- Пристром, А. М. Артериальная гипертензия беременных: диагностика, классификация, клинические формы: учебное пособие / А. М. Пристром. — Минск, 2011. – 103 с
- Гипертензивные расстройства во время беременности, в родах и послеродовом периоде. Преэклампсия. Эклампсия: федеральные клинические рекомендации / Г. Т. Сухих [и др.]. — Москва, 2013. – 85 с.
- Пристром, А.М. Дифференцированная медикаментозная терапия артериальной гипертензии у беременных / А.М. Пристром, А.Г. Мрочек // Современные аспекты профилактики, диагностики и лечения артериальной гипертензии: материалы IV Междунар. науч.-практ. конф. – Витебск, 2007. – С. 115-119
- Гипертензивные расстройства во время беременности, в родах и послеродовом периоде. Преэклампсия. Эклампсия: федеральные клинические рекомендации / Г. Т. Су-хих [и др.]. — Москва, 2013. – 85 с.
- Антиперович, Т.Г. Острая цереброваскулярная патология в период беременности и после родов: ретроспективный анализ случаев материнской смертности / Т.Г. Антиперович, О.А. Пересада, А.В. Астапенко // Мед. новости. – 2005. – № 1. – С. 88-91.
КАК ОЦЕНИТЬ РИСК?
Три шага
УЗИ
КРОВЬ
КОНСУЛЬТАЦИЯ
Своевременное выявление и лечение помогает до 90% беременных. Пройдите скрининг сейчас:
+7 (495) 514-00-11
В настоящее время существуют специальные диагностические программы, которые помогают своевременно обнаружить, что закладка функции плаценты происходит неправильно. Обследования можно проводить в первом триместре и даже до наступления беременности.
В соответствии с международными рекомендациями и российскими программами скрининга, для выявления высокого риска преэклампсии используются следующие методы диагностики:
- УЗИ плода, плаценты и ультразвуковая допплерометрия маточных артерий. Исследование должен проводить врач, у которого есть сертификат Фонда Медицины Плода FMF (Fetal Medicine Foundation). УЗИ в скрининге ПЭ
- Анализ крови на ХГЧАнализ крови на ХГЧ (хорионический гонадотропин) – повышение более 3 MoM в первом или втором триместре. Мифы и заблуждения о пренатальном скрининге.
- Анализ крови на PAPP-A (связанный с беременностью плазменный протеин A). Снижение его уровня говорит о повышенном риске преэклампсии. СМОТРЕТЬ ВИДЕО
- Анализ крови на ингибин A – повышение уровня в I–II триместре.
- Анализ крови на PLGF (фактор роста плаценты).При высоком риске преэклампсии на 13–16 неделях беременности снижается уровень PIGF. Анализ на него можно провести уже в первом триместре.
- Анализ крови на sFlt-1 и PLGF. Это соотношение можно исследовать после 20 недели беременности. Примерно за 5 недель до возникновения первых признаков преэклампсии повышается sFlt. При высоком риске преэклампсии PIGF будет снижен, а sFlt – повышен. Очень подробно для специалистов
- Анализ крови на АФП (альфа-фетопротеин) – повышение уровня во втором триместре, которое не удается объяснить другими причинами.
Важно понимать: ни одно отдельно взятое исследование не помогает прогнозировать риск преэклампсии во время беременности. Скрининговые обследования включают разные тесты, и их результаты нужно оценивать в комплексе. В некоторых случаях требуется расширенное обследование – его можно пройти в нашем Центре иммунологии и репродукции.
До наступления беременности проводится ряд исследований, связанных с генетической предрасположенностью к нарушениям плацентарной функции.
- Полиморфизм генов системы гемостаза.
- Полиморфизм генов сосудистого тонуса.
- Антифосфолипидные антитела.
Приказ Минздрава РФ № 572н от 1.11.2012 г. «Об утверждении порядка оказания медицинской помощи по профилю акушерство и гинекология (за исключением использования вспомогательных репродуктивных технологий)» предписывает проходить будущим мамам УЗИ и сдавать анализы на PAPP-A, hCG на сроке 11–14 недель беременности. В некоторых регионах России и западных странах проводят три анализа, к списку добавляется PLGF. Это исследование называют тройным тестом первого триместра.
Описание
Преэклампсия (код по МКБ10: О14 Вызванная беременностью гипертензия со значительной протеинурией) – патологическое, специфическое для беременности состояние женщины, развивающееся во второй половине беременности (после 20 недель) и характеризующееся артериальной гипертензией, увеличением количества белка в моче, отеками, полиорганной недостаточностью.
Распространенность преэклампсии в мире в среднем составляет 0,9-3%. В России этот показатель выше и колеблется в пределах 12-17% от общего числа беременностей.
Основным фактором, определяющим наличие заболевания, является иммунологический конфликт матери с плодом и плодной частью плаценты. В первом триместре беременности трофобласт (прототип плаценты) полноценно не прорастает в ткани матки. В дальнейшем это влечет за собой недоразвитие плаценты, в итоге количество маточно-плацентарного кровотока снижается. В результате к 20 неделе беременности устанавливается оксидативный стресс плаценты. Это состояние характеризуется увеличением количества окислителей из-за длительной гипоксии (в основном супероксида кислорода) и относительным или абсолютным уменьшением количества антиоксидантов.
За дисбалансом окислителей и антиоксидантов следует окисление белков, липидов и выход продуктов окисления в кровоток матери. Эти продукты влияют на функцию эндотелия, покрывающего изнутри сосуды. Как следствие, к эндотелию «прилипают» тромбоциты, лейкоциты. Данное состояние приводит к нарушению функций сосудов, их сужению, уменьшению циркулирующей крови, повышенному риску развития синдрома диссеминированного внутрисосудистого свертывания.
Профилактика преэклампсии
Если симптомы преэклампсии уже возникли, будущую маму помещают в стационар, назначают постельный режим, препараты для снижения артериального давления, глюкокортикостероиды, противосудорожные средства (при тяжелом течении). Всё это помогает лишь несколько улучшить состояние, единственный способ избавиться от преэклампсии – родоразрешение.
Для женщин с высоким риском существуют эффективные средства профилактики:
- Аспирин в низких дозах (75 мг ежедневно). Лечение начинают с самых ранних сроков беременности или даже до зачатия и продолжают до родов. Аспирин для профилактики
- В некоторых случаях терапия дополняется препаратами гепаринового ряда. Курантил (дипиридамол) не назначается для профилактики преэклампсии. Почему?
При правильной профилактике аспирином риск преэклампсии сильно снижается. Например, есть данные о том, что 150 мг аспирина ежедневно с 11–14 по 34 недели беременности снижают риск ранней преэклампсии на 60%, до 34 недель – на 80%, до 32 недель – на 90%. Именно на ранних сроках беременности преэклампсия особенно опасна, потому что может встать вопрос о необходимости скорейшего родоразрешения, при этом организм малыша еще не созрел, не готов появиться на свет.
СМОТРЕТЬ ВИДЕО
Народные средства
При первых появлениях симптомов (отечность ног, повышение артериального давления) ближе к 20 недели беременности необходимо немедленно обратиться к специалисту.
Для эффективного лечение и сохранения плода нужно соблюдать назначенное врачом лечение. Прием лекарственных трав и средств народной медицины при легкой преэклампсии не запрещен, но делать это можно только с разрешения лечащего врача для коррекции выбранной дополнительной терапии.
В качестве средств, способствующих нормализации артериального давления, применяют плоды боярышника, цветы васильков, настой пустырника. При появлении отеков 1 степени (отек нижних конечностей) допускается применение диуретических средств фитотерапии: артишока, листьев березы, кукурузных рыльцев, репейника. В качестве вспомогательной терапии применяют успокаивающие средства (мяту, валериану, пустырник, мелиссу, кипрей), а также антигопиксантные травы, фрукты (сушеные плоды абрикоса, сливы, листья березы, мелиссу, липу).
Информация носит справочный характер и не является руководством к действию. Не занимайтесь самолечением. При первых симптомах заболевания обратитесь к врачу.
Примеры диагностики и лечения преэклампсии
Предлагаем вашему вниманию два реальных клинических случая женщин, которые проходили обследование и лечение во время беременности по поводу преэклампсии в нашем Центре Иммунологии и Репродукции:
Бабак Татьяна Александровна
Акушер-гинеколог, гинеколог-эндокринолог, гемостазиолог
1 случай
С февраля 2021 года, на 6–7 неделе беременности в нашей клинике наблюдается Маргарита В. 1984 г. р. Акушерско-гинекологический анамнез женщины не отягощен. Первичное обследование, проведенное на сроке 8–9 недель, выявило повышение уровня Д-димера. В связи с этим пациентке рекомендовано дообследование на тромбофилические факторы. Выявлены полиморфизмы генов системы гемостаза: гомозиготный по гену фибриногена, гену ITGA2, PAI 1, гетерозиготный по гену MTHFR. Уровень гомоцистеина – в норме.
Нашими врачами было предложено провести анализы на полиморфизмы генов сосудистого тонуса, антифосфолипидные антитела, но пациентка отказалась.
Результаты первого и второго биохимического скрининга:
- Первый скрининг: низкий уровень плацентарного фактора роста (0,41).
- Второй скрининг: уровень свободного эстриола 0,61.
С 11-12 недель пациентка получает ТромбоАсс 100 мг и клексан 0,2 мл подкожно 1 раз в сутки. При допплерометрии на 20–21 неделе беременности выявлено нарушение кровотока в маточных артериях 1а степени. По данным гемостазиограммы — периодически повышен уровень Д-димера. В 19-20 недель — резко повышен уровень sFlt 1. На данный момент пациентка продолжает находиться под наблюдением, наши доктора ведут беременность.
Обследование выявило повышенный риск преэклампсии, и благодаря этому наши доктора с первого триместра начали проводить профилактику. Мы ожидаем, что это поможет снизить вероятность того, что из-за преэклампсии пациентке потребуется родоразрешение на слишком раннем сроке.
Бабак Татьяна Александровна
Акушер-гинеколог, гинеколог-эндокринолог, гемостазиолог
2 случай
В июне 2021 года на сроке 5–6 недель беременности в ЦИР обратилась Татьяна Л. 1988 г. р. У женщины первая беременность, акушерско-гинекологический анамнез не отягощен.
Анализ на сроке 11–12 недель выявил незначительное повышение уровня Д-димера. На этом же сроке были скудные кровянистые выделения из влагалища.
Результаты биохимических скринингов:
- Первый скрининг: без отклонений (уровень PAPPa, PLGF — 0,9-1,0).
- Второй скрининг: снова норма (плацентарные гормоны в районе 1-1,5).
Во время УЗИ с 20 недели было обнаружено нарушение кровотока в маточных артериях 1а степени. Наши доктора назначили женщине ТРомбоАСС 100 мг/сут. с 21 недели. Далее к нему добавили клексан 0,2 мл/сут. с 28 недели.
В 36 недели было проведено УЗИ, которое показало синдром задержки внутриутробного развития плода (СЗВРП) 1 степени. С 37 недель у пациентки стало повышаться артериальное давление до 140/90 мм. рт. ст., в моче был обнаружен белок (протеинурия).
На 37–38 неделе беременности по показаниям (из-за СЗВРП и острой гипоксии плода) было выполнено экстренное кесарево сечение. На свет появился мальчик с массой тела 2540 граммов, длиной тела 48 см. Сейчас с ребенком все хорошо, он нормально развивается.
В этом примере своевременно выявленный риск преэклампсии и меры профилактики помогли сохранить беременность до максимально возможного в данном случае срока, дать организму ребенка созреть, чтобы он был готов появиться на свет.
Лекарства
Фото: d-russia.ru
Блокаторы кальциевых каналов (преимущественно смешанного действия). Препараты данной группы тормозят поступление кальция в кардиомиоциты (мышечные клетки сердца) и в гладкомышечные клетки (ГМК, мышцы в сосудах). Из-за этого периферические сосуды расширяются. Это уменьшает артериальное давление, общее периферическое сопротивление сосудов, постнагрузку на сердце. Коронарные сосуды (снабжающие кровью сердце) также расширяются и приносят больше кислорода к кардиомиоцитам. Препараты незначительно снижают сократимость сердца, а вместе с этим уменьшается потребность в кислороде и постнагрузка. Противопоказания: артериальная гипотензия, сердечная недостаточность, коллапс, кардиогенный шок, повышенная чувствительность к препарату (аллергия).
Бета1-адреноблокаторы. Действие препаратов данной группы заключается в снижении активности симпатической нервной системы и циркулирующих катехоламинов на сердце. Благодаря этому уменьшается частота сердечных сокращений, за счет уменьшения ударного объема и минутного кровотока снижается артериальное давление и общее периферическое сопротивление сосудов. Противопоказания: атриовентрикулярная блока 2 и 3 степеней, синоатриальная блокада, артериальная гипотензия, брадикардия, хроническая и острая сердечная недостаточность, кардиогенный шок, повышенная чувствительность к препарату (аллергия).
Гипотензивные средства центрального действия. Эффект достигается воздействием препаратов (или их метаболитов) на рецепторы сосудодвигательного центра в продолговатом мозге. В результате чего симпатическая активность на сосуды снижается. В основном гипотензивное действие оказывается за счет снижения общего периферического сопротивления сосудов. В незначительной степени снижаются частота сердечных сокращений и сердечный выброс. Противопоказания: острые и хронические заболевания печени, заболевания почек, феохромоцитома, депрессия, прием средств, угнетающих деятельность центральной нервной системы, паркинсонизм, повышенная чувствительность к препарату (аллергия).
Степени тяжести
Вероятность риска для здоровья и жизни будущей матери и плода зависит от характеристик основных признаков преэклампсии.
Легкая степень:
- артериальное давление – 140-150/90-100 мм рт. ст.;
- белок в моче – до 1 г/л;
- отеки ног.
Умеренная степень:
- артериальное давление – 150-170/110 мм рт. ст.;
- белок в моче – 5 г/л;
- креатинин в крови – 100-300 мкмоль/л;
- отеки на передней брюшной стенке и руках.
Тяжелая степень:
- артериальное давление – 170/110 мм рт. ст.;
- белок в моче – более 5 г/л;
- креатинин в крови – более 300 мкмоль/л;
- отеки слизистой носа и лица;
- изменения со стороны зрения и боли в животе.