Острая тромбоцитопеническая пурпура
Острая тромбоцитопеническая пурпура (син. постинфекционная, или гаптеновая, Пурпура тромбоцитопеническая
).
Этиология и патогенез
Тромбоцитопения (см.) развивается вследствие повышенного разрушения кровяных пластинок. Причины повышенной деструкции тромбоцитов (см.) при этой форме П. т. изучены недостаточно. Основное значение придают избытку в крови комплексов антиген — антитело (см. Антиген-антитело реакция) , образующихся в ответ на внедрение вируса. Связывание иммунных комплексов с определенным локусом мембраны тромбоцитов (Fc-рецептором) создает предпосылки для гибели последних. Тромбоциты, нагруженные иммунными комплексами, фагоцитируются в селезенке и печени или разрушаются под действием комплемента (см.) непосредственно в кровеносном русле. Вполне вероятно, что тромбоциты могут разрушаться под действием антител, направленных против модифицированных вирусом тромбоцитарных аутоантигенов. После выведения вируса и его антигенов из организма антителообразование прекращается, уровень деструкции тромбоцитов нормализуется, наступает выздоровление.
Клиническая картина
Наблюдается преимущественно у детей дошкольного и младшего школьного возраста. Начинается остро.
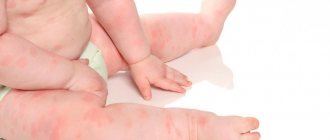
Клинической манифестации заболевания в 80—85% случаев предшествует период лихорадки, часто связанной с такими вирусными инфекциями, как краснуха (см.), корь (см.), ветряная оспа (см.), грипп (см.). Описаны случаи П. т. после вакцинации. Интервал от начала инфекции до возникновения П. т. колеблется от 3 дней до 3 нед. Характерны высыпания различных размеров, включая петехиальные, кровоточивость десен. Возможны желудочные и почечные кровотечения. В 10—20% случаев отмечается незначительное увеличение селезенки и печени. У 60% детей наблюдается умеренная лимфаденопатия. Кровоизлияния в мозг возможны в первые 2 нед. заболевания, особенно при наличии петехий на лице, кровоизлияний в слизистую оболочку полости рта и конъюнктиву. В крови обычно регистрируются глубокая тромбоцитопения (меньше 20 000 в 1 мкл), в 80% случаев — относительный лимфоцитоз, в 20% — эозинофилия. При радиоизотопном исследовании отмечается резкое укорочение продолжительности жизни тромбоцитов, иногда до нескольких часов. Компенсаторное повышение их продукции сопровождается увеличением числа мегакариоцитов в костном мозге и появлением в крови гигантских форм кровяных пластинок.
Диагноз
Диагноз основывается на исключении симптоматических форм П. т. и обычно не вызывает затруднений. Иммунный характер заболевания подтверждает обнаружение повышенного по сравнению с нормой содержания иммуноглобулина класса G (антител) на поверхности тромбоцитов.
Лечение и прогноз
Назначают преднизолон в дозе 1—3 мг/кг веса (массы) на 3—4 нед. По данным Лашера и Айера (J. М. Lusher, R. Iyer), глюкокортикоидные гормоны не уменьшают длительность заболевания и обычно не изменяют уровень тромбоцитов, однако они купируют геморрагический синдром и уменьшают вероятность кровоизлияния в мозг. Трансфузии тромбоцитов чаще всего неэффективны; переливание больших количеств тромбоцитов иногда приводит к прекращению кровоточивости.
Заболевание длится несколько недель или месяцев; обычно заканчивается спонтанным выздоровлением через 1—2 мес. (максимум 6 мес.); выздоровление констатируется у 80% больных, у остальных приобретает хроническое течение. Смертность ок. 1%. Целесообразно воздерживаться от спленэктомии на протяжении этого срока, исключая случаи, когда операция должна выполняться по витальным показаниям (некупируемый большими дозами преднизолона криз, выраженный геморрагический синдром, появление симптомов, свидетельствующих о возможности кровоизлияния В мозг). Цитостатическая терапия при этой форме П. т. нецелесообразна. Если тромбоцитопения персистирует более 6 мес., можно думать о хронической форме болезни (см. ниже).
Профилактика кровотечений
при острой форме П. т. заключается в ограничении в разгаре болезни подвижности, исключении возможности травмы. Противопоказан прием лекарственных средств, нарушающих функцию тромбоцитов.
Общие сведения
Тромбоцитопеническая пурпура – это группа гематологических заболеваний различной этиологии, которая сводится к снижению количества кровяных пластинок – тромбоцитов ниже 150х10 в девятой степени на литр крови, вызванное нарушением тромбоцитарного звена гемостаза. Чаще всего развивается вследствие аутоиммунных процессов воздействия антитромбоцитарных антител и деструкции макрофагами.
Хроническая тромбоцитопеническая пурпура
Хроническая тромбоцитопеническая пурпура (син. аутоиммунная П. т.). Впервые эту форму П. т. описал в 1735 г. Верльгоф (P. G. Werlhof). Франк (А. Е. Frank, 1915) первым предположил, что при П. т. снижается продукция тромбоцитов под влиянием фактора, вырабатываемого селезенкой. Почти полвека эта гипотеза оставалась популярной, но не подтвержденной. Альтернативная версия принадлежала Катцнельсону (P. Katznelson, 1916), который отметил положительный эффект спленэктомии при П. т. и на этом основании утверждал, что тромбоцитопения развивается в результате повышенной деструкции тромбоцитов в селезенке; в последние два десятилетия это было подтверждено многочисленными исследованиями.
Этиология и патогенез
Причины заболевания неизвестны. В классических опытах Харрингтона (W. J. Harrington, 1951— 1953), произведенных им на себе и сотрудниках лаборатории, было установлено, что в гамма-глобулиновой фракции плазмы крови у 60% больных П. т. содержится фактор, введение к-рого здоровым людям индуцирует тромбоцитопению. В последующем было показано, что антитромбоцитарный фактор является иммуноглобулином класса G (см. Иммуноглобулины), что он способен взаимодействовать с тромбоцитами как антитело и может быть обнаружен на поверхности кровяных пластинок больного в 95% случаев. Мак-Миллан (R. McMillan) с сотрудниками доказали, что антитромбоцитарный IgG, синтезированный in vitro лимфоцитами больных П. т., способен связываться не только с собственными, но и с донорскими, т. е. не измененными в антигенном отношении тромбоцитами (см.). Как донорские, так и аутологичные тромбоциты обладают митогенной активностью и способны вызывать бласттрансформацию лимфоцитов больных П. т. Перечисленные данные явились основанием для отнесения этой формы П. т. к группе так наз. аутоиммунных заболеваний (см. Аутоаллергические болезни). Патогенез длительно перси-стирующих тромбоцитопений, при которых иммунол. пробы оказываются отрицательными, окончательно не установлен. Антитромбоцитарный (антитела), связываясь с тромбоцитами, не только нарушает функцию последних, но и обусловливает их последующее разрушение в селезенке и печени. Специфичность антитромбоцитарных антител при аутоиммунной тромбоцитопении неизвестна, однако доказано, что у разных больных они фиксируются к различным локусам тромбоцитарной мембраны. Повышенное разрушение тромбоцитов подтверждается значительным укорочением продолжительности жизни меченных изотопом клеток. В равновесном состоянии уровень продукции тромбоцитов превышает нормальный в 2—8 раз. Отражением этого процесса служит увеличение в костном мозге количества и (или) размеров мегакариоцитов и появление в крови незрелых, увеличенных в размерах тромбоцитов (см. Костный мозг). Повышенная кровоточивость при П. т. связана как с дефицитом кровяных пластинок, так и с нарушением их функции под действием антител. Именно поэтому при данном заболевании в отличие от амегакариоцитарных тромбоцитопений, при которых выраженность геморрагического синдрома четко коррелирует со степенью дефицита кровяных пластинок, значительная кровоточивость может наблюдаться и при умеренном снижении уровня тромбоцитов.
Патологическая анатомия
Основным объектом патологоанатомического исследования является удаленная селезенка (см.). При проведении спленэктомии (см.) и подозрении на хронический активный гепатит (см.) и симптоматический характер дефицита кровяных пластинок производят краевую биопсию печени (см. Печень, методы исследования).
Селезенка в большинстве случаев имеет нормальные размеры и массу, иногда увеличена (до 400 г). Микроскопически часто выявляется гиперплазия лимф, ткани, при этом увеличено количество и размеры фолликулов, они содержат крупные зародышевые центры, окруженные кольцом зрелых лимфоцитов, к к-рому примыкает широкая маргинальная зона из незрелых лимфоидных элементов. В некоторых случаях зародышевые центры бедны клетками, их ткань пропитана белковыми массами; подобные изменения наблюдаются преимущественно при длительном применении кортикостероидных гормонов. В красной пульпе селезенки часто отмечается увеличение количества эозинофилов, плазматических клеток, могут выявляться скопления ядерных форм клеток красного ряда, мегакариоци ты; в зародышевых центрах, маргинальных зонах и пульпарных тяжах, как правило, увеличено количество мононуклеарных фагоцитов. Иногда в ткани селезенки обнаруживают группы ксантомных клеток (липоидные макрофаги, гошеподобные клетки), которые образуются, по-видимому, в результате фагоцитоза макрофагами разрушенных тромбоцитов. Часто наблюдается массивное накопление белковых субстанций в стенках центральных и пульпарных артерий, мембранах синусов с их утолщением и последующим склерозом. Эндотелий синусов гиперплазирован.
В печени обнаруживают белковую и жировую дистрофию гепатоцитов, выраженную в различной степени гиперплазию звездчатых эндотелиоцитов. Трепанобиопсия (см.) гребешка подвздошной кости выявляет полиморфный по клеточному составу костный мозг, значительное увеличение количества мегакариоцитов с наличием среди них незрелых форм. В случаях массивных повторных кровотечений или сопутствующего гемолиза может наблюдаться увеличение ядерных элементов клеток красного ряда.
Клиническая картина
Чаще наблюдается в 20—50-летнем возрасте, реже у детей. Женщины болеют в 3—4 раза чаще, чем мужчины. Болезнь проявляется постепенно, исподволь, реже остро, при этом может быть обнаружена связь с различными провоцирующими моментами (вирусной или бактериальной инфекцией, избыточной инсоляцией, травмой). Тромбоцитопенический геморрагический синдром характеризуется кожными проявлениями (экхимозы, петехии, экстравазаты на местах инъекций) и кровотечениями из слизистых оболочек. Появление геморрагий на лице, в конъюнктиве глаз, на губах, является серьезным симптомом, свидетельствующим о возможности кровоизлияния В мозг (см. Инсульт). Кровотечение из жел.-киш. тракта, гематурия, кровохарканье наблюдаются реже. Увеличение размеров селезенки не характерно. При спленомегалии (см.), даже незначительной, необходимо исключить симптоматический характер дефицита кровяных пластинок. В редких случаях число тромбоцитов самопроизвольно нормализуется. Обычно это наблюдается не позже, чем через 6 месяцев с момента появления первых симптомов заболевания, т. е. речь может идти об острой (постинфекционной) П. т. (см. выше).
В крови регистрируется тромбоцитопения различной выраженности (обычно число тромбоцитов не превышает 75 000 в 1 мкл), нередко обнаруживается повышенное содержание гигантских форм тромбоцитов с голубой цитоплазмой. При содержании тромбоцитов выше 50 000 в 1 мкл геморрагический синдром наблюдается редко. При исследовании костного мозга выявляется увеличенное или нормальное количество мегакариоцитов. Значительная часть из них представлена молодыми формами, имеющими увеличенные размеры и базофильную цитоплазму. Отсутствие тромбоцитов вокруг мегакариоцитов не является доказательством нарушенной отшнуровки тромбоцитарных субъединиц, а свидетельствует об ускоренном поступлении клеток в кровь или о разрушении их в костном мозге. Иногда в костном мозге отмечается раздражение красного ростка, связанное с кровотечениями. Эритроидная гиперплазия может быть обусловлена сопутствующим гемолизом (см.), который подтверждает обнаружение антиэритроцитарных антител с помощью антиглобулинов ой пробы Кумбса (см. Кумбса реакция). Время кровотечения (см.) удлинено. Ретракция кровяного сгустка уменьшена (см. Ретракция). Свертываемость крови в большинстве случаев нормальная (см. Свертывающая система крови). Иногда в крови обнаруживают продукты деградации фибриногена. У некоторых больных выявляется уменьшение адгезии тромбоцитов к стеклу, нарушение аденозиндифосфат-, тромбин-, коллаген-агрегации. По данным В. Г. Савченко и Л. И. Идельсона (1981), при иммунол. исследовании определяется повышенное по сравнению с нормой содержание IgG на поверхности тромбоцитов больного, что косвенно подтверждает факт наличия антитромбоцитарных антител.
Диагноз
Диагноз основывается на исключении наследственных и симптоматических форм П. т. (см. Тромбоцитопения). В диагностически сложных ситуациях может быть использован метод количественного определения IgG на поверхности аутологичных тромбоцитов, разработанный Диксоном и Россе (R. Dixon, W. Rosse). Непрямые (сывороточные) методики в настоящее время практически не используются из-за низкой информативности. Отдифференцировать острую (постинфекционную) П. т. от хронической (аутоиммунной) с помощью иммунологических методов на ранних этапах невозможно. При установлении диагноза учитывают, что острая (постинфекционная) тромбоцитопеническая пурпура наблюдается преимущественно у детей, длится несколько недель или месяцев и обычно заканчивается спонтанным выздоровлением через 1 — 2, максимум 6 мес.
Лабораторные исследования
Характерны снижение содержания тромбоцитов в крови вплоть до единичных в препарате и увеличение времени кровотечения. Длительность кровотечения не всегда соответствует степени тромбоцитопении, так как она зависит не только от количества тромбоцитов, но и от их качественных характеристик. Значительно снижена или не наступает вообще ретракция кровяного сгустка. Вторично (в результате тромбоцитопении) изменяются плазменно-коагуляционные свойства крови, что проявляется недостаточностью образования тромбопластина в связи с дефицитом 3-го тромбоцитарного фактора. Нарушение образования тромбопластина приводит к снижению потребления протромбина в процессе свёртывания крови. В некоторых случаях при тромбоцитопенической пурпуре в период криза отмечают активацию фибринолитической системы и повышение антикоагулянтной активности (антитромбины, гепарин). У всех больных с тромбоцитопенией снижена концентрация серотонина в крови. Эндотелиальные пробы (жгута, щипка, молоточковая, уколочная) в период гематологического криза положительны. В красной крови и лейкограмме (при отсутствии кровопотерь) изменений не находят. При исследовании красного костного мозга обычно выявляют нормальное или повышенное содержание мегакариоцитов.
Диагностика
Обследование — задача гематолога. Как правило, процесс первичен, потому привлекать других врачей не приходится почти никогда. За редкими исключениями.
Доктор оценивает клинические данные. Жалобы пациента на здоровье и самочувствие. Это позволяет составить представление о симптомах, подвести комплекс признаков под определенные схемы, выдвинуть гипотезы.
Также важно собрать анамнез. Перенесенные и текущие заболевания, особенности беременности у матери (если известны такие моменты), вредные привычки и прочие факты.
Оба рутинных исследования играют большую роль в первичной диагностике. Затем начинается собственно выявление патологического процесса.
- Общий анализ крови. Дает представление о концентрации тромбоцитов в биоматериале. Надежный и информативный метод, несмотря на всю простоту.
- Коагулограмма. Оценке подлежит скорость свертывания жидкой ткани.
- При необходимости назначается иммунологическое исследование, ИФА.
- В сложных и спорных случаях проводится пункция костного мозга. Обычно диагноз очевиден и без столь радикальных мер.
Диагностика сравнительно проста. Заболевание обнаруживается и классифицируется по совокупности объективных данных и полученной от пациента информации в части анамнеза, жалоб.
Этиология заболевания
В большинстве случаев определить причины возникновения пурпуры тромбоцитопенической невозможно, хотя учёные смогли выяснить то, что генетические дефекты не играют основную роль в её развитии. Иногда она возникает на фоне наследственных патологий, связанных с нарушением производства тромбоцитопоэтинов в организме или снижения ферментов, входящих в цикл Кребса, но это единичные случаи.
К наиболее вероятным причинам, которые могут вызвать пурпуру, врачи относят:
- сбои в работе кроветворной системы, вызванные развитием апластической анемии;
- опухолевые поражения костного мозга;
- пагубное влияние радиации на человеческий организм, которое вызывает нарушение миелопоэза – процесса развития и созревания форменных элементов крови;
- перенесённая бактериальная или вирусная инфекция (по статистике, в 40% случаев болезнь Верльгофа возникает именно из-за этого);
- операции по протезированию сосудов, которые могли стать причиной механического повреждения тромбоцитов;
- патологическая реакция организма на введение гамма-глобулина;
- применение некоторых противозачаточных препаратов;
- химиотерапия с целью лечения онкологии.
Иногда причиной развития болезни у взрослых становится коллагеноз аутоиммунной природы, длительный застой крови или беременность (этот факт подтверждён немногими учёными и врачами, поэтому о нём упоминают редко).
Лечение
Терапия преимущественно медикаментозная. Применяются лекарства нескольких типов.
- Кортикостероиды. Преднизолон, в более сложных случаях — Дексаметазон, как мощный аналог. Для купирования воспалительных процессов, торможения аутоиммунной реакции. Клинические проявления при использовании таких средств резко ослабевают.
- Гипериммунные глобулины. назначаются с той же целью.
- Применяются цитостатики. Обычно эта категория показана в рамках лечения раковых заболеваний. Они замедляют рост так называемых «быстрых» клеток. Волос, ногтей, опухолей.
К таковым же относятся и структуры защитных сил организма. Иммунная тромбоцитопеническая пурпура лечится с помощью препаратов данной групп всегда, без них смысла в терапии нет, конкретные наименования подбираются врачом. Такие медикаменты крайне опасны.
При выраженных нарушениях функций крови возможно переливание плазмы, жидкой фракции. По показаниям.
Не всегда консервативные методики достаточно эффективны. В такой ситуации перспективным вариантом становится удаление селезенки.
Согласно исследованиям и полученным статистическим данным, вероятность благоприятного исхода при такой терапии достигает почти 70%.
Лечение ориентировано на особенности в каждом конкретном случае, тем более, что и форм пурпуры существует несколько.
При беременности
Тромбоцитопеническая пурпура обычно представляет угрозу как для матери, так и для плода, особенно если наблюдаются частые рецидивы. Беременность вызывает её обострение чаще во втором-третьем триместре. В трети случаев развивается гестоз.
Угроза выкидыша достаточно высока – примерно 25%, возможна отслойка плаценты. Чаще всего обнаруживается слабая родовая деятельность и послеродовые кровотечения.
Осложнения у плода и новорожденного ребенка выражаются в виде глубокой недоношенности, внутричерепных кровоизлияний, гипотрофии и гипоксии плода, анемии у новорожденных, послеродовых петехиальных кровотечений, мелены, гематурии.
Норма тромбоцитов в крови
| Возраст | Значение, тыс./мкл |
| Дети | |
| До 1 года | 160-390 |
| 1 год – 10 лет | 180-320 |
| 10 – 16 лет | 180-350 |
| Мужчины | |
| Старше 16 лет | 200-400 |
| Женщины | |
| до 16 лет | 180-340 |
| Менструация и неделя после ее завершения | 75-220 |
| Здоровая женщина после 16 лет | 180-320 |
| Беременность | 100-420 |
Факторы риска
Тромбоцитопеническая пурпура может обнаруживаться у детей и взрослых любого возраста, но существуют факторы, которые увеличивают риск развития этого состояния:
- принадлежность к женскому полу (у женщин тромбоцитопеническая пурпура встречается в три раза чаще чем у мужчин);
- недавно перенесенное инфекционное заболевание увеличивает риск развития болезни, особенно у детей;
- наследственность (заболевание у близких родственников повышает риск возникновения тромбоцитопении);
- частые стрессы.
Последствия и осложнения
Хроническое снижение уровня тромбоцитов в периферическом кровотоке может приводить к тяжелым состояниям и заболеваниям:
- массивная кровопотеря;
- гипохромная анемия – снижение содержания гемоглобина менее 30 пкг;
- сидеропеническое состояние – комплекс клинических проявлений, обусловленный дефицитом железа при прогрессирующей анемии, характеризуется шелушением и сухостью кожи, атрофией эпителия языка, носа, глотки и пищевода, развитием атрофического гастрита, мышечной слабостью, слабостью сфинктера мочевика, атонией ЖКТ, нарушением сократительной функции сердца, обмороками, снижением сопротивляемости к инфекциям.
Причины
Частично вопрос уже был затронут ранее. Если говорить о конкретных факторах-провокаторах:
- Отягощенная семейная история. До конца влияние этого момента не изучено, но уже можно говорить о повышенных рисках, если один или, тем более, несколько родственников по восходящей линии имели тромбоцитическую пурпуру в анамнезе.
- Прием некоторых медикаментов. Противовоспалительных нестероидного происхождения, антибиотиков и прочих. Вариантов множество. Лекарственная форма имеет нестабильное течение и склонна к самостоятельному регрессу спустя какое-то время.
- Инфекционные процессы любой локализации. Вирусные, бактериальные или грибковые. Особую опасность несут штаммы герпеса, пиогенная флора (например, золотистый стафилококк).
- Проведенные оперативные вмешательства. В недавнем прошлом. Таким образом организм может ответить на травмирующий фактор извне.
- Переливание крови. Сравнительно редко тромбоцитопеническая пурпура такого происхождения дает критические нарушения. Обычно это преходящее расстройство, но протекает оно остро. и требуется стационарная помощь.
- Прямая передача антител плоду.
- Иммунологическая несовместимость матери и ребенка.
- Аутоиммунные процессы. Воспалительные. По типу красной волчанки, ревматизма, артрита, тиреоидита (поражение щитовидной железы). Вопрос не в локализации, а в самой сути явления.
Такие патологические процессы сопровождаются гиперсенсибилизацией организма, повышением чувствительности к малейшему влиянию.
Толчком к пурпуре может стать все что угодно. От аллергена в пище до перенесенной простуды или длительного нахождения на солнце.
- Врожденные патологии костного мозга. Приводят к недостаточному синтезу тромбоцитов. Это хроническое расстройство, оно требует постоянного медикаментозного лечения, регулярных осмотров у гематолога. Лейкозы, злокачественные опухоли.
Причины всегда болезнетворные. Но не во всех случаях удается обнаружить виновника нарушения.
Часто врачи говорят об идиопатической форме, тогда терапия сводится к купированию симптомов и предотвращению прогрессирования.
Профилактика
Поскольку механизмы и причины возникновения болезни Верльгофа в настоящее время изучены недостаточно, средств первичной профилактики, которые могли бы полностью предотвратить развитие заболевания, не разработано. Вторичная профилактика, направленная на предотвращение рецидивов и обострений болезни, заключается в:
- минимизации риска травм;
- избегании контактов с инфекционными больными;
- диете (исключить острую пищу, алкоголь, кофеин);
- избегании прямых солнечных лучей, солярия, некоторых физиопроцедур (УВЧ, УФО).
- освобождении от занятий физкультурой.
Болезнь Верльгофа — серьёзное заболевание, которое может привести к различным осложнениям. Поэтому родителям необходимо внимательно следить за самочувствием своего ребёнка. При появлении любых симптомов нужно как можно скорее обратиться к врачу. Соблюдение рекомендаций специалиста поможет сохранить здоровье вашему малышу.