Геморрагические лихорадки
Патогенез геморрагических состояний при геморрагических лихорадках. Тромбогеморрагический синдром (синдром Мачабели) является важным звеном патогенеза многих инфекционных болезней. Тромбогеморрагический синдром — это симптомокомплекс, обусловленный универсальным и неспецифическим свойством крови, лимфы, тканевой жидкости, клеточных и межклеточных структур обратимо и необратимо сгущаться вследствие активации их способности к коагуляции и в результате ретракции расслаиваться на компоненты различного агрегатного состояния. Тромбогеморрагический синдром в своем развитии проходит 4 стадии. Стадия гиперкоагуляции начинается в клетках тканей поврежденного органа, что приводит к высвобождению коагуляционно-активных веществ, реакция активации коагуляции распространяется на кровь. Эта стадия обычно кратковременная.
Стадия нарастающей коагулопатии потребления, непостоянной фибриполитической активности. Она характеризуется падением числа тромбоцитов и уровня фибриногена, а также расходом других плазменных факторов коагуляционнолитической системы организма. Это — стадия начинающегося и нарастающего ДВС (неполный синдром ДВС).
Стадия дефибриногенации и тотального, но не постоянного фибринолиза (дефибриногенационно-фибринолитическая). Синоним этой стадии — полный синдром ДВС.
Восстановительная стадия или стадия остаточных тромбозов и окклюзии. При благоприятном течении синдрома отмечается возвращение к физиологическим нормам всех факторов коагуляционнолитической системы организма.
По клиническим проявлениям различают различные формы тромбогеморрагического синдрома (молниеносный, острый, хронический, латентный, геморрагический, гиперергический и др.). Тромбогеморрагический синдром наблюдается при травмах, хирургических заболеваниях, в онкологии, при акушерской патологии, при сепсисе и многих инфекционных болезнях. В настоящей главе мы рассматриваем только особенности патогенеза геморрагического синдрома при геморрагических лихорадках.
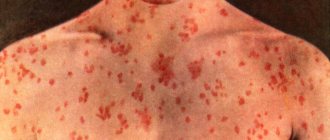
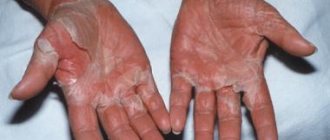
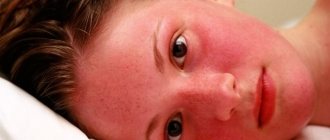
При геморрагических лихорадках первичная патология страдания развивается на клеточно-молекулярном уровне с обязательным вовлечением в инфекционный процесс эндотелиальных клеток кровеносной системы и стволовых полипотентных клеток костного мозга. Скорость развития процесса обусловлена агрессивностью патогена и его тропностью и к другим чувствительным клеткам, например, макрофагам-моноцитам, а также степенью зрелости иммунной системы пораженного конкретным возбудителем индивидуума. В итоге нормальный физиологический уровень функционирования эндотелия и кроветворных органов динамически меняется. В разгар инфекции происходит тотальное изменение анатомо-морфологической целостности и, соответственно, функций системы микроциркуляции крови. Оно сопровождается ухудшением трофики всех органов и тканей, развивается гипоксия и их функциональная недостаточность. Процесс сопровождается нарушением деятельности терморегулирующего и координирующего центров ЦНС, сердечно-сосудистой и выделительной систем, развивается легочная или иная органная патология и нередко больные погибают в коматозном состоянии. Угрожающая жизни объемная потеря крови редка, хотя повышенная кровоточивость, как признак изменения сосудистой проницаемости, выступает в качестве одного из ведущих симптомов геморрагических вирусных лихорадок.
Среди причин геморрагического синдрома, развивающегося достаточно быстро и часто заканчивающегося смертью больных, известны вирусы пяти семейств: Arena-, Bunya-, Filo-, Flavi- и Togaviridae. Они включают вирусы Ласса, Хунин, Мачупо, Гуанарито, Сэбия (семейство аренавиру-сов) — возбудители, соответственно, лихорадок Ласса, Аргентинской, Боливийской, Венесуэльской и Бразильской; лихорадки долины рифт и Крым Конго (семейство буньявирусов); желтой лихорадки (семейство флавивирусов); лихорадок Марбург и Эбола (семейство филовирусов), лихорадки денге, къясанурской лесной болезни и геморрагической лихорадки с почечным синдромом (семейства тогавирусов). Возбудители клещевых риккетсиозов, эрлихиозов и группы сыпного тифа, напротив, причастны к геморрагическому синдрому с более медленным и большей частью доброкачественным течением. Следовательно, по привязанности к возбудителю инфекционной болезни геморрагический синдром полиэтиологичен.
Широкий спектр возбудителей, вызывающих единый по клинике комплекс симптомов, обусловлен однотипным механизмом его формирования. Из данных морфологического и иммуногистологического изучения вышеуказанных заболеваний известно, что основная патология развертывается в эндотелиальных клетках микродиркуляторной системы, клетках костного мозга и для некоторых инфекций (лихорадки Марбург, денге) в процесс вовлекаются мононуклеарные фагоциты, как циркулирующие в русле крови, так и тканевые. Это находит отражение в клеточном, белковом и пептидном (кинины, лейкотриены) составе крови и балансе ее биологически активных компонентов. Затрагивается деятельность систем комплемента, кининовой, коагуляции и антикоагуляции. Последние регулируют тонус сосудов, их проницаемость, секреторную деятельность эндотелия, реологические свойства крови и ответственны за субъективные ощущения боли, усталости и другую симптоматику болезней.
Несмотря на этиологическое разнообразие патогенов, ассоциируемых с развитием геморрагического синдрома, их объединяет идентичный или весьма близкий механизм доставки возбудителя к клеткам-мишеням на начальной стадии инфекционного процесса. Возбудители лихорадок, передающиеся с участием кровососущих переносчиков, контактно через расчесы кожи или аэрогенно через альвеолярно-капиллярные мембраны легких, по существу механически переносятся к чувствительным к патогену клеткам эндотелия и тканевым оседлым макрофагам в местах микротравм, вызванных колюще-сосущим аппаратом переносчиков или повреждением эпителия. Именно в этих точках или же в альвеолярно-капиллярных мембранах, на которых произошла задержка частиц инфекционного аэрозоля, формируется первичный локальный процесс. Защитная реакция у места входных ворот сопровождается и одновременной генерализацией инфекционного процесса вследствие диссеминации возбудителя с крово-лимфооттоком с дальнейшим последовательно нарастающим поражением клеток-мишеней в органах и тканях, удаленных от места входных ворот инфекции. При этом часть частичек возбудителя поглощается макрофагами и другими клетками крови, например, эритроцитами при риккетсиозах и бартонеллезах, но не инактивируется вследствие недостаточной концентрации цитокинов, таких как интерферонгамма (ИНФ-у), фактора некроза опухоли-альфа (ФНО-а), других монокинов и отсутствия специфических нейтрализующих антител в плазме крови на момент заражения и в начальный период болезни.
Локальное повреждение физиологически высокоактивных, регулирующих гемостаз клеток в области входных ворот патогена и одновременная генерализация инфекции с трансмиссивным механизмом передачи предопределены особенностями кровососания клещей и комаров, переносчиков возбудителей большинства геморрагических лихорадок, и особенностями анатомического строения тканевых и альвеолярных капилляров. Синхронность формирования локального и генерализованного процессов объясняется тем, что кровососание у переносчиков длится долго и прерывисто, особенно у клещей (до нескольких суток). Периодический отсос крови сопровождается периодическим же вспрыскиванием в капилляр слюны, а в некоторых случаях и коксальной жидкости, содержащих патоген, антикоагулянты и ферменты кровососа.
Инфекционный процесс на уровне клетка-возбудитель начинается по обычной для внутриклеточных паразитов схеме: прикрепление к поверхностной мембране и ее разрыхление, проникновение в цитоплазму, размножение или гибель (в случае абортивной инфекции), выход в окружающее межклеточное пространство или русло крови, с инфицированием прилегающих и отдаленных интактных клеток. Последняя стадия взаимодействия клетка-патоген сопровождается либо разрушением и некролизом первой, либо усилением внутриклеточных физиологических процессов с повышенной продукцией цитокинов и других метаболитов их нормального функционирования.
Процесс преодоления клеточной стенки патогеном небезразличен для макроорганизма: липополисахариды мембраны расщепляются фосфолипазами переносчика и возбудителя. Как следствие, освобождается арахидоновая кислота — субстрат-предшественник биологически наиболее активных эйкозаноидов (простагландин Е2(ПГЕ9), тромбооксаны, фактор активации тромбоцитов (ФАТ), интерлейкин-I (ИЛ-1) и другие), ответственные в макроорганизме за тонус и проницаемость малых артериол и прекапилляров, хемотаксилс лейкоцитов, терморегуляцию, чувство боли и другие реакции организма, объединяемые общим названием «эндогенный токсикоз».
Репродукция возбудителя в эндотелиальных клетках по электронно-микроскопическим наблюдениям сопровождается их набуханием и вакуолизацией, а затем и явной патологией — отслоением от базальной мембраны на участках капиллярывенулы или от нижележащих клеток в более крупных сосудах и появлением части клеток эндотелия в русле крови. На стыке капилляровенулы возникают анатомические дефекты с оголением части базальной мембраны. Слабость сосудистых стенок в этих локусах при прогрессирующем избытке ПГЕ2, ФАТ и других цитокинов обусловливает стойкое расширение просвета венул с увеличением их кровенаполнения; кровоток замедляется, формируются лейкоцитарно-тромбоцитарный стаз, гипотензия по периферическому типу, а затем отеки и геморрагии вследствие экссудации плазмы и миграции клеток крови в периваскулярное пространство из посткапиллярных венул. Первоначально процесс экссудации компенсируется, но нарастание инфекционного процесса в целом с расширением деструктивно-воспалительных изменений в сосудистой и макрофагальной системах преодолевает «порог» компенсаторных защитных реакций организма. Последний очевидно определяется особенностями конституционального иммунитета заболевшего, возрастной степенью зрелости его иммунной системы и вирулентностью патогена. Время преодоления порога компенсаторного ответа скорее всего определяется (совпадает) с окончанием очередного цикла репродукции возбудителя, проявляется нарастанием структурно-функциональных клеточных изменений негативного характера и появлением возбудителя в крови и в экссудатах на поверхности слизистых оболочек и коже. В клетках возрастает количество пероксидов, а в плазме — эйкозаноидов. По мере диссеминации возбудителя выраженность локальных процессов и множественность заражения макроорганизма прогрессивно возрастают, сопровождаясь появлением и развитием у инфицированного неопределенных симптомов болезни, создающих общее ощущение дискомфорта. В этот начальный период болезни, помимо количественных изменений медиаторов и цитокинов, начинает проявляться дисбаланс в системе коагуляции-антикоагуляции крови, в состоянии больного наступает резкое ухудшение, что обычно ощущается им как начало болезни. С этого времени и в разгар болезни в тканях и крови больного происходят кардинальные изменения. Отток плазмы в межклеточные пространства декомпенсируется, периваскулярная лейкоцитарная инфильтрация, диапедез эритроцитов и сгущение крови возрастают, формируются симптомы «сладжа».
Повышенная агрегация тромбоцитов и миграция лейкоцитов-нейтрофилов в стенки сосудов и околососудистые щели активизируют фактор Хагемана (фактор XII), «пусковой» компонент каскада свертывания. На фоне тромбоцитопении и лейкопении развиваются симптомы гиперкоагуляции, свойственные I стадии ДВС-синдрома.
Дальнейшая прогрессирующая структурно-функциональная дезорганизация эндотелия, герминтативных точек стволовых клеток костного мозга и других (при желтой лихорадке и лихорадке Марбург — гепатоцитов и мононуклеарных фагоцитов) приводит к нарастанию капилляропатии и, соответственно, токсикоза, вплоть до развития инфекционно-токсической энцефалопатии (ИТЭ) с полной утратой сознания и восприятия окружающей среды, т.е. развивается состояние комы (синоним, ИТЭ III-й степени. Динамически колеблется уровень цитокинов и медиаторов, причастных к пирогенезу (ПГЕз, ИЛ-1, лейкотриены), коагуляции — антикоагуляции, начинает снижаться синтез колониестимулирующих факторов (КСФ). Уменьшение КСФ сопровождается подавлением процесса самообновления полипотентных стволовых клеток; направление дифференциации клеток крови, в частности нейтрофилов, и их созревание меняются.
Необычное против физиологической нормы содержание продуктов распада клеток, затронутых патогеном, и усиление синтеза и секреции эйкозаноидов на начальной стадии инфекционного процесса сопровождается возрастающей недостаточностью выделительной функции почек и обезвреживающей деятельности печени из-за ишемии, а при некоторых геморрагических инфекциях и вследствие ее прямого поражения возбудителем, синхронно протекающего с затронутостью эндотелия и других клеток. Для ГЛПС с более медленным по сравнению с лихорадками Марбург и Эбола течением васкулярные тромбы и некроз клеток эндотелия нехарактерны, а клиника обусловлена генерализованным расширением капилляров, отеками, инфильтрацией крупных органов и лимфатических узлов гранулоцитами. Для данной нозоформы наиболее заметна возросшая проницаемость капилляров, в том числе и нефронов, отражающая дисфункцию эндотелия в сочетании с дисбалансом медиаторов и других регуляторных компонентов гемостаза.
На завершающей стадии вирусных геморрагических лихорадок с неблагоприятным исходом сохраняются тромбоцитопения вследствие убыли тромбоцитов в агрегаты и микротромбы, дефицит фактора Хагемана, тромбооксана А2, других медиаторов, фаза гипокоагуляции плавно переходит в состояние глубокой гипокоагуляции с развитием соответствующей симптоматики — многократно увеличивается время свертываемости крови, уровень тромбоцитов и лейкоцитов максимально низок, кровоточивость достигает максимума, тогда как температура тела снижается.
Таким образом, патогенез геморрагических состояний при геморрагических лихорадках отражает комплекс динамически протекающих сопряженных процессов, наслаивающихся друг на друга, основу которых составляет: — разрегулирование нормального физиологического соотношения компонентов систем, обеспечивающих гемостаз (см. выше), в связи с изменением секреторной деятельности клеток, причастных к гемостазу; — анатомо-морфологическое обнажение стенок кровеносных сосудов в наиболее активной (в аспекте ее функциональной деятельности) части, а именно — в участках микроциркуляции (артериола-капилляр-венула); — повышение проницаемости сосудов из-за нарушения их целостности и меняющегося содержания в крови вазоактивных компонентов (тромбоцитов, эйкозаноидов, кининов, адреналина и других фармакологически активных соединений); — отставанием иммунологически важных защитных реакций макроорганизма, в том числе и в виде формирования специфических антител, от нарастания деструктивных изменений при генерализации инфекционного процесса; — суммарным формированием ДВС-симптоматики различной степени выраженности.
При этом изменения в крови последовательно развиваются через фазу гиперкоагуляции в стадию гипокоагуляции с обязательной тромбо- и лейкопенией потребления и сдвигом формулы нейтрофилов влево. Скорость развития симптоматики и исход болезни определяются степенью патогенности возбудителя, конституциональными особенностями и иммунным статусом заболевшего.
Этиология
Возбудителями патологии являются вирусы различных семейств, тропные к эндотелиоцитам кровеносных сосудов. Их переносят насекомые – клещи и комары. В организме человека и некоторых животных микробы персистируют долгое время. Естественными хозяевами опасных вирусов являются летучие мыши, белки, грызуны, дикобразы и приматы.
Трансмиссивный путь распространения инфекции является основным и реализуется через укусы насекомых.
Среди прочих путей заражение выделяют:
- Воздушно-пылевой,
- Парентеральный,
- Алиментарный,
- Водный,
- Контактный.
Микробы проникают в организм человека через мелкие царапины, ссадины и раны на коже. Воздушно-пылевой путь реализуется путем вдыхания пыли, содержащей частицы экскрементов животных. Заражение также возможно при употреблении в пищу зараженных продуктов. Высок риск заражения у медицинских работников, оказывающих помощь больным людям во время вспышек инфекции.
Основные патогенетические звенья геморрагической лихорадки:
- Воспаление эндотелиального слоя сосудов,
- Разрушение сосудистой стенки,
- Капилляротоксикоз,
- Кровоизлияния в кожные и слизистые покровы,
- Выброс в кровь медиаторов воспаления и веществ с цитотоксическим действием,
- Выраженные трофические изменения в клетках,
- Диссеминированное внутрисосудистое свертывание,
- Недостаточное поступление кислорода в ткани,
- Дисфункция внутренних органов и систем,
- Массивная кровопотеря.
Геморрагическая лихорадка — опасная патология, которая даже при своевременном и правильном лечении может закончиться смертью больного.
ГЛПС – эпидемиология заболевания
Главным источником вирусных частиц считаются мышевидные грызуны.
Грызуны переносят данную инфекцию бессимптомно. В окружающую среду вирус выделяется с испражнениями и мочой.
Инфицирование человека осуществляется аспирационными и контактными путями.
Внимание. При аспирационном инфицировании происходит аспирация (вдыхание) вируса из остатков высохших испражнений грызунов.
Контактное инфицирование реализуется при непосредственных контактах с грызунами, а также материалами и поверхностями, загрязненными их испражнениями (сено, зерна, солома и т.д.).
Также возможно алиментарное инфицирование, реализуемое при употреблении термически необработанных продуктов, загрязненных испражнениями больных грызунов.
Справочно. Инфицированные люди не представляют эпидемической опасности, так как от человека к человеку заболевание не передается.
Показатель естественной чувствительности к возбудителю заболевания высокий во всех возрастных группах.
Чаще всего (приблизительно в восьмидесяти-девяноста процентах всех случаев) ГЛПС регистрируется у лиц мужского пола от шестнадцати до пятидесяти лет.
Заболевание развивается преимущественно у работников сельской промышленности, трактористов и т.д.
Справочно. После перенесенной инфекции происходит формирование пожизненного типоспецифического иммунитета.
Природные очаги данной инфекции регистрируются по всему миру. На территории России заболевание регистрируется во всех районах. Наиболее распространена данная инфекция на территории Татарстана, Башкортостана и т.д.
В структуре заболеваемости отмечается выраженная сезонность. ГЛПС регистрируется преимущественно с мая по декабрь.
Диагностика
Диагностика патологии начинается с опроса больного и сбора анамнеза. Специалисты выясняют, в каком регионе проживает больной, имел ли он контакты с животными, кусали ли его насекомые. Насторожить врачей должны высокая температура тела и геморрагические проявления.
Лабораторная диагностика позволяет подтвердить или опровергнуть предполагаемый диагноз. Наиболее информативные лабораторные методики:
- Общеклинический анализ крови и мочи,
- Биохимическое исследование крови,
- Коагулограмма,
- Исследование кала на скрытую кровь,
- Серодиагностика — РСК, РНИФ, РН, РТГА, РИА,
- Иммунологическое исследование крови,
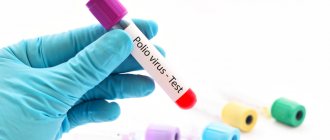
- ИФА,
- ПЦР-диагностика,
- Выделение и исследование вирусов.
Этиологические факторы заболевания
ГЛПС относятся к распространенным на территории Евразии очагово-природным инфекционным патологиям. Чаще всего заболевание регистрируют на территории Китая и Российской Федерации.
Возбудителем заболевания являются арбовирусы, входящие в семейство Bunyaviridae. Данный тип вирусов относят к хантавирусам.
Справочно. ГЛПС вызывают четыре серовара (группа микроорганизмов, принадлежащих одному виду) данного вируса: Пуумала, Добрава-Белград, Сеул и Хантаан.
Проявления инфекционного процесса не зависят от типа серовара возбудителя.
На территории России и чаще всего регистрируются ГЛПС, вызванная вирусами типа Добрава-Белград и Пуумала.
Справочно. Вирусы, вызывающие данный тип ГЛ, отличаются высоким уровнем чувствительности к воздействию дез. растворов и ультрафиолета. Также вирусы в течение получаса инактивируются при воздействии температуры выше пятидесяти градусов.
При температуре до двадцати градусов и при температуре ниже -20 градусов, вирус отличается относительной устойчивостью. В образцах крови, при температуре до 4 градусов, вирус может сохраняться в течение четырех дней.
Причины
Недуг могут спровоцировать:
- буньявирусы;
- тогавирусы;
- аренавирусы;
- филовирусы;
- флавивирусы.
Для данной группы недугов характерна природная очаговость. Это говорит о том, что они наиболее распространены в местах, где проживает много животных, а также переносчиков вирусов, к которым относят комаров и клещей. Животные-переносчики:
- грызуны (мышиная лихорадка);
- белки;
- обезьяны;
- летучие мыши.
Но стоит отметить тот факт, что для недугов характерны такие пути распространения – парентеральный и воздушно-пылевой, водный, пищевой.
ГЛПС – что это
Справочно. ГЛПС – это острая вирусно-зоонозная очагово-природная инфекция.
Характеризуется:
- системными повреждениями микроциркуляторных сосудистых структур,
- развитием диатезов геморрагического характера,
- тяжелыми расстройствами гемодинамики,
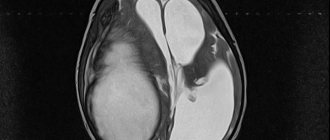
- поражением тканей почек,
- развитием тяжелых нарушений в работе почек.
Данный тип геморрагических лихорадок также называют:
- геморрагический нефрозонефрит,
- эпид. нефрозонефрит,
- маньчжурская лихорадка, и т.д.
Согласно классификации МКБ10 данная инфекция классифицируется как А98.5.
Лечение
Геморрагическая лихорадка требует срочной госпитализации. Лечение проводят в инфекционном боксе стационара или в реанимационном отделении. Больным проводят гемостатическую, заместительную, десенсибилизирующую и симптоматическую терапию. Если больные поступают в стационар в шоковом состоянии, им вводят «Допамина», сердечные гликозиды, «Реополиглюкин».
Больным показан строгий постельный режим и диетотерапия. В разгар болезни назначают парентеральное питание, а в период выздоровления – растительно-молочную легкую пищу, обогащенную витаминами РР, С, В или К. Максимально полезны овощные и фруктовые отвары, соки, настои, морсы.
- Заместительная терапия — важный момент лечения. Больным показано переливание компонентов крови – внутривенное введение тромбоцитарной массы, факторов свертывания, препаратов железа.
- Дезинтоксикационная терапия — внутривенное введение солевых растворов, раствора глюкозы, «Гемодеза», «Реополиглюкина».
- Противовирусная терапия – «Амиксин», «Ингавирин», «Анаферон», «Кагоцел».
- Витаминотерапия – витамины С, Р.
- Кровоостанавливающая терапия – «Викасол», «Дицинон», «Этамзилат».
- Противогистаминные средства – «Супрастин», «Диазолин», «Тавегил».
- Жаропонижающие средства – «Ибуклин», «Нурофен».
- Противоболевые средства – «Кеторол», «Пенталгин», «Спазган».
- Дезагреганты – «Аспирин», «Кардиомагнил», «Тромбоасс».
- Для улучшения микроциркуляции назначают «Гепарин», «Клексан», «Фраксипарин».
- Ангиопротекторы и антиоксиданты – «Актовегин», «Винпоцетин».
- Мочегонные средства при развитии почечных осложнений – «Лазикс», «Фуросемид».
- Гемодиализ применим в том случае, если наблюдается поражение почек.
Грамотно проведенное комплексное лечение позволяет значительно снизить риск развития осложнений и ускорить процесс выздоровления.