Печеночная энцефалопатия – это состояние, сопровождающееся нарушением нормальной работы головного мозга, которое произошло из-за ухудшения функционирования печени. Если печень «отключается» резко, то есть в короткие сроки страдает сразу большое количество ее ткани, наступает острая печеночная энцефалопатия – состояние, характеризующееся нарастающей сонливостью, которое в большинстве случаев заканчивается летально. Когда же печеночная ткань теряет свои клетки постепенно, работа мозга тоже ухудшается не сразу. Вначале страдают личностные и интеллектуальные функции, и только через длительный период времени человек становится сонливым и впадает в кому.
Печеночная энцефалопатия – состояние, которое требует врачебной помощи. При остром нарушении работы мозга проводится медикаментозная коррекция. Она направлена на частичное замещение основных функций печени (полностью взять на себя работу печеночной ткани медицина не в состоянии), пока ее ткань не восстановится. Хроническая печеночная энцефалопатия имеет больше шансов на излечение: в большинстве случаев пересадка доли печени может полностью спасти ситуацию, вернув человеку здоровье и личность.
Народное лечение может применяться только при хронической печеночной энцефалопатии, но только по рекомендации врача и только в качестве дополнения к основной терапии.
Печеночная энцефалопатия — что это
Под термином «острая печеночная энцефалопатия» подразумевают комплекс нервно-психической симптоматики, развивающийся у пациентов с печеночными дисфункциями.
Причиной возникновения печеночных энцефалопатий могут быть острые отравления, поражения гепатоцитарных клеток токсического генеза, ишемическое поражение гепатоцитарных клеток, некротическое поражение гепатоцитов при циррозах, острые жировые печеночные дистрофии.
Формирование острых печеночных энцефалопатий является грозным осложнением и свидетельствует о выраженной декомпенсации печеночных функций.
Печеночная энцефалопатия при циррозе печени часто развивается на терминальных стадиях заболевания. Однако, в некоторых случаях у больных с медленно прогрессирующими цирротическими состояниями ПЭ может протекать годами, с эпизодами обострений.
Справочно. Ведущими проявлениями печеночной энцефалопатии (ПЭ) являются прогрессирующие психические расстройства (интеллектуальные нарушения, изменение личности, заторможенность, неадекватность поведения, бред и т.д.), появление высоко специфического хлопающего тремора и приторного запаха («печеночный» запах).
У пациентов с хроническими печеночными недостаточностями симптомы ПЭ могут быть смазанными. В таком случае, чтобы уточнить диагноз и отличить ПЭ от депрессивных состояний, маний, психозов применяются специальные тесты на печеночную энцефалопатию.
Следует отметить, что даже минимально выраженные и стертые симптомы заболевания приводят к значительному ухудшению качества жизни больного.
Клинические рекомендации по лечению взрослых людей
Лечение печеночной энцефалопатии – многозадачный процесс. Первое, на что должны быть направлены силы медицинского персонала, это поиск устранение тех факторов, которые вызвали этот синдром.
Параллельно следует подойти к решению проблемы ликвидации избытка токсинов, в том числе указанного выше аммиака. В последнюю очередь осуществляется коррекция нарушенного баланса нейромедиаторов. Этот этап выполним в условиях терапевтического или гастроэнтерологического отделения.
Важно на всех этапах лечения независимо от стадии печеночной энцефалопатии поддерживать водно-электролитный гомеостаз. Для этих целей используют белковые растворы. Иногда можно заменять на гипертонический раствор глюкозы (10 %). Так снижается уровень интоксикации и концентрация опасных для организма токсинов.
Для коррекции уровня калия крови (для профилактики остановки сердца или жизненно опасных нарушений сердечного ритма) используют мочегонные средства. При гипокалиемии их отменяют, но очень осторожно, под контролем цифр артериального давления.
Современные клинические рекомендации по ведению пациентов с печеночной энцефалопатией основаны на уменьшении образования аммиака. С этой целью специалисты советуют применять свечи Лактитол. Альтернативный вариант – сернокислая магнезия. В этом случае важно мониторировать артериальное давление.
Антибактериальная терапия оправдана для того, чтобы ликвидировать азотпродуцирующие микроорганизмы, обильно населяющие кишечник и являющиеся источником большого количества токсичного аммиака. Назначают Рифаксимин или Метронидазол. По современным рекомендациям лучше остановиться на Неомицине.
Патогенетически целесообразно назначать в качестве профилактики стресс-язв Омез, Нексиум, Квамател или другие антисекреторные средства.
Как развивается острая печеночная энцефалопатия
Основными механизмами и причинами развития ПЭ являются:
- остро возникшие или протекающие хронические заболевания печени, приводящие к выраженному нарушению ее детоксицирующей функции (способность удалять токсины);
- развитие шунтов между портальным и общим кровотоком, вследствие чего токсины кишечного происхождения попадают в ткани головного мозга.
Справочно. Ведущую роль в поражении нервной системы играют эндогенные (продуцируемые организмом) нейротоксины (аммиак, меркаптаны, некоторые жирные кислоты, фенолы).
Значительно повышенный уровень аммиака в крови отмечается более чем у девяноста процентов пациентов с острыми печеночными энцефалопатиями. Также отмечается его высокий уровень в тканях головного мозга.
Помимо прямого поражения нейротоксинами тканей нервной системы, развитию симптомов печеночной энцефалопатии способствует нарушение синтетической функции печени, приводящее к снижению выработки веществ и нейромедиаторов, необходимых для полноценного функционирования ЦНС.
Также следует отметить, что в тканях головного мозга не осуществляется мочевинный цикл, поэтому утилизация избытка аммиака представляет значительные трудности.
При выраженном повышении показателей аммиака в тканях головного мозга, у пациентов с печеночными энцефалопатиями отмечается истощение возбуждающих медиаторов (в первую очередь — глутамата).
Также происходит поражение тканей головного мозга меркаптанами, фенолами.
Причинами поражения нервной системы нейротоксинами являются:
- повышенная продукция данных веществ в кишечнике;
- нарушение моторики желудочно-кишечного тракта;
- развитие порто-системных шунтирований;
- нарушение утилизации продуктов белкового обмена гепатоцитарным клетками;
- снижение степени нейтрализации аммиака мышечной тканью.
Также отмечается развитие отека мозговых клеток без специфических признаков внутричерепной гипертензии.
Справочно. Следует отметить, что наличие у пациента заболеваний кишечника, запоров, кровотечений из ЖКТ, а также в случае употребления большого количества пищи, богатой белками, симптомы острой ПЭ протекают гораздо тяжелее.
При полном исключении или резком ограничении белкового рациона в рационе часто удается устранить неврологическую симптоматику и значительно снизить вероятность развития рецидива.
У пациентов с критически высоким уровнем аммиака в крови признаки печеночной энцефалопатии могут проявляться появлением патологического возбуждения, спутанности сознания, бредовых припадков, зрительных нарушений. В дальнейшем отмечается присоединение тошноты, сонливости, нарушений сердечного ритма.
Терапия
Лечение печеночной энцефалопатии организуют исключительно в условиях стационара, больных помещают в отделение интенсивной терапии. Цель лечения сводится к восстановлению работоспособности печени, ликвидации отравляющего влияния аммиака на мозг.
Комплексная терапия подразумевает:
- Организацию специальной низкобелковой диеты.
- Медикаментозное лечение.
- Дезинтоксикационные мероприятия.
- Симптоматическое лечение.
Медикаментозное лечение сводится к назначению ряда лекарственных средств.
В частности препаратов лактулозы цель которых — подавлять синтез аммиака в кишечнике и выводить его избыток с калом. Дополнительно препараты лактулозы снижают избыточный рост патогенной кишечной микрофлоры.
Антибиотикотерапия сводится к пероральному приему лекарств, внутривенные препараты нежелательны из-за создания высокой нагрузки на печень. Прием антибиотиков помогает уничтожить вредоносную флору в кишечнике, вырабатывающую аммиак.
Назначаются средства, нормализующие расщепление аммиака в печени. Подобные препараты используют внутривенно, в максимальной дозировке.
Прием сорбентов позволяет своевременно выводить кишечные токсины, не допуская их всасывания в кровь.
С помощью специальных препаратов снижают выработку кислого желудочного сока.
К числу обязательных лечебных мероприятий относят инфузионную терапию путем внутривенного вливания полиионных и глюкозо-калий-инсулиновых растворов. Для улучшения свертываемости крови проводят переливание плазмы. Пациентам с критически высоким уровнем калия в крови организуют гемодиализ.
Пациентам показаны ежедневные высокие клизмы с использованием прохладного 1% содового раствора. Проведение клизм необходимо для выведения из организма кишечных метаболитов. К тому же, по окрашенной воде или цвету каловых масс можно своевременно распознать начало внутреннего кровотечения из кишечника.
Хирургическое вмешательство сводится к проведению операций в виде:
- Трансяремного внутрипеченочного портокавального шунтирования (TIPS). После операции у пациентов стабилизируется давление в воротной вене, нормализуется кровоснабжение печени, уменьшается негативная симптоматика.
- Трансплантации печени от донора. Пересадка железы показана при острых и хронических декомпенсированных формах.
Пациентам в обязательном порядке назначается диета, цель которой — снизить выделение аммиака в кишечнике и его концентрацию в плазме крови благодаря исключению из рациона белковой пищи. Однако питание должно обеспечивать потребности организма в калориях и энергии.
Недостаток аминокислот восполняют с помощью специальных смесей. Для пациентов в бессознательном состоянии смеси вводят через зонд.
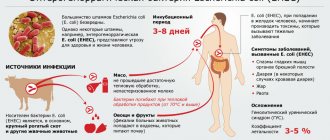
Печеночная энцефалопатия — причины
Справочно. Ведущими причинами развития острых печеночных энцефалопатий являются алкогольные циррозы печени и тяжелые поражения печеночных тканей на фоне вирусных гепатитов (как острых, так и хронических).
При этом, у пациентов с цирротическим перерождением печени данные осложнения могут как развиваться остро (при терминальной стадии печеночного цирроза), так и медленно прогрессировать (в таком случае, печеночная энцефалопатия может протекать волнообразно, с периодами нормализации состояния и периодами обострений).
Развитие ПЭ является крайне неблагоприятным признаком. У пациентов с цирротическим перерождением печеночных тканей, развитие ПЭ увеличивает вероятность летального исхода в течение года на пятьдесят процентов.
Внимание. В течение пяти лет после постановки диагноза «печеночная энцефалопатия» умирает более восьмидесяти процентов больных.
Кроме гепатитов и цирроза алкогольного генеза, причинами развития печеночной энцефалопатии могут быть:
- токсические поражения печеночных тканей;
- наследственные патологии печени, сопровождающиеся нарушением ее синтетической и детоксикационной функций;
- ишемические гепатиты;
- бактериальные инфекции, сопровождающиеся развитием инфекционно-токсического шока и сепсиса;
- острые поражения гепатоцитарных клеток у беременных;
- диссеминированное внутрисосудистое свертывание крови;
- поражение печени при длительном лечении гепатотоксичными препаратами;
- первичные и вторичные билиарные циррозы;
- сердечная недостаточность, сопровождающаяся формированием портальных гипертензий.
Факторами риска, у пациентов с печеночными патологиями, способствующими развитию тяжелых острых печеночных энцефалопатий, являются:
- наличие у пациента острых или хронических патологий ЖКТ;
- инфицирование Helicobacter pylori (данные бактерии способны продуцировать аммиак);
- употребление большого количества белковой пищи;
- преклонный возраст пациента;
- гипогликемические состояния;
- отек мозга, обусловленный развитием острой печеночной недостаточности;
- терминальные стадии циррозов печени;
- длительный прием антидепрессантов или снотворных средств;
- наличие у пациента желудочно-кишечных кровотечений.
Диагностические меры
Помимо оценки жалоб и симптомов патологии, для постановки диагноза необходимо провести различные исследования, и на основании данных, полученных в ходе обследования, поставить окончательный диагноз. Наиболее информативными считаются следующие методы:
- Печеночные пробы для определения уровня билирубина (при развитии поражений печени его показатели повышаются);
- Коагулограмма для определения протромбинового индекса (он снижен);
- ОАМ (в моче повышается билирубин и уробилин);
- УЗИ печени для определения ее размеров (данное исследование позволяет распознать форму течения патологии, при острой печень уменьшается в размерах, при хронической, напротив, увеличивается);
- Биопсия тканей пораженного органа для подтверждения диагноза.
Печеночная энцефалопатия — симптомы
В список симптомов печеночной энцефалопатии входят специфические психические и нервно-мышечные изменения, а также изменения на электроэнцефалограмме.
Учитывая, что при развитии ПЭ происходит поражение всех мозговых отделов, симптоматика ПЭ достаточно разнообразна.
Основными проявлениями патологии являются развитие у пациента:
- личностных расстройств (пациенты постоянно раздражительны и рассеяны, у них отсутствует интерес к семье, они ведут себя ребячливо);
- расстройств сна;
- фиксированного взгляда, заторможенности, появление аппатичности;
- речевых нарушений (монотонная медленная речь, краткие ответы на все вопросы);
- интеллектуальных нарушений (трудности в начертании прямых линий, подсчетах, снижение памяти);
- хлопающих треморов (астериксисов) и появление сладковато-приторного запаха изо рта;
- непроизвольных мочеиспусканий и дефекаций.
К ранним признакам данного осложнения относят появление личностных нарушений. Наиболее выражена данная симптоматика ПЭ у пациентов с хроническими поражениями гепатоцитарных клеток.
Поведение пациентов становится «детским», они становятся капризными, раздражительными, может наблюдаться плаксивость. Отмечаются частые перепады настроения. У некоторых пациентов на первый план выходит депрессивная симптоматика.
При прогрессировании ПЭ могут появляться неврозы, маниакально-депрессивные состояния, мании, бред.
Симптомы, связанные с личностными нарушениями, могут сохраняться даже на фоне ремиссии заболевания. Симптомы и степень их прогрессирования в таком случае оценивают при помощи специальных психометрических тестов.
Справочно. У лиц, с минимальными печеночными энцефалопатиями отсутствуют нарушения интеллекта и речи, а также координационные нарушения, однако у них часто регистрируется патологическая отвлекаемость и нарушение внимания.
Дополнительные симптомы
У пациентов также наблюдаются проблемы с опознаванием предметов, отмечается изменение почерка, нарушается способность рисовать сложные фигуры и проводить прямые линии.
Интеллектуальные нарушения могут варьировать от легкой заторможенности и замедленной реакции, до полной неадекватности поведения больного.
Речевые нарушения при печеночных энцефалопатиях проявляются замедлением речи, нарушением логической структуры предложений, монотонностью речи, невнятностью голоса.
При развитии отека мозга на фоне ПЭ пациентов беспокоит постоянная сонливость, заторможенность, апатичность, вялость, подавленность, депрессивность.
Справочно. Частым проявлением ПЭ является специфический запах дыхания больного (сладковато-приторный аромат).
При прогрессировании симптомов поражения нервной системы отмечается появление астериксиса (человек не в состоянии зафиксировать и поддерживать какую-либо позу тела), дезориентации в пространстве, выраженное нарушение моторики и координации движений.
При развитии комы на фоне данного заболевания отмечается резкое снижение рефлексов, заторможенность, затуманенность сознания, обмороки, исчезновение патологического тремора конечностей, исчезновение реакции на раздражители, стойкое расширение зрачков.
Симптомы по степени тяжести ПЭ
При невыраженных поражениях ЦНС при ПЭ отмечается появление патологической рассеянности и отвлекаемости, нарушений сна, постоянной раздражительности и эмоциональной неустойчивости, неспособности концентрировать внимание, появление постоянного тремора конечностей, легкой шаткости походки.
В среднетяжелом течении ПЭ отмечается постоянная сонливость, появление заторможенности и безразличия к окружающим, нарушение пространственной и временной ориентации, повышение активности рефлексов, появление патологических рефлексов, развитие астериксиса, появление значительных личностных расстройств и интеллектуальных нарушений, монотонность голоса, появление речевых нарушений.
Справочно. Тяжелое течение ПЭ, сопровождающееся развитием комы, проявляется полной пространственной и временной, а также личностной дезориентацией, тяжелейшей заторможенностью, потерей сознания, появлением судорожной симптоматики, непроизвольной дефекацией и мочеиспусканием, появлением патологических рефлексов, мышечной ригидностью, появлением агрессивности, бреда, резко выраженного «печеночного» аромата.
При фульминантных, острых печеночных недостаточностях прогрессирование ПЭ сопровождается развитием истинной (эндогенной) печеночной комы. У пациентов с терминальными формами печеночных патологий отмечается развитие ложных, шунтовых или порто-кавальных ком.
Симптомы и первые признаки
В клинических проявлениях различают неврологические нарушения и расстройства психики. К характерным проявлениям энцефалопатии относят астериксис – крупноразмашистые подергивания конечностей. Появляются из-за тонического напряжения мышц на фоне нарушения функций нервной системы.
Общие признаки печеночной энцефалопатии:
- фиксация взгляда;
- пространственная дезориентация;
- бессонница;
- монотонность речи;
- забывчивость;
- тревожность;
- печеночный тремор;
- снижение интеллекта;
- безучастность;
- нарушение речи и письма;
- понижение температуры тела;
- обмороки;
- отсутствие полового влечения.
Заторможенность, сонливость, бессонница – первые признаки патологии. В связи с нарушением метаболизма появляется неприятный запах изо рта. На декомпенсированной стадии пациенты становятся агрессивными или апатичными, неадекватно реагируют на окружающую обстановку.
На предпоследней (терминальной) стадии происходит угнетение ЦНС. Больные не реагируют на раздражающие факторы, кроме боли. В коматозном состоянии нередки сильные судороги, которые спровоцированы гипертонусом мышц. На стадии комы 9 из 10 пациентов погибают, не приходя в сознание.
Диагностика печеночных энцефалопатий
Основная цель диагностических мероприятий — подтвердить наличие заболевание, определить его причины, особенности и стадию.
В разговоре с больным врач собирает информацию о беспокоящих его явлениях, заболеваниях печени в анамнезе, принимаемых лекарствах. Специалист назначает консультацию гастроэнтеролога и невропатолога, общий и биохимический анализ крови, коагулограмму, тест на маркеры гепатитов.
Проведенные исследования позволят выявить наличие воспаления, определить уровень свертываемости крови, мочевины, щелочной фосфатазы, креатинина, других элементов.
Выставление диагноза основывается на:
- анамнестических данных (хронические, прогрессирующие заболевания печени, острые печеночные дисфункции, алкогольные циррозы);
- результатах оценки неврологического статуса, моторики и психометрических тестов на печеночную энцефалопатию;
- данных электроэнцефалограммы (замедление а-ритмов, появление низких амплитуд, удлинение латентного периода);
- результатах спектроскопии магнитных резонансов (глутаминовые пики, низкий уровень миоинозитолов/креатининов);
- оценке специфической симптоматики;
- выявлении прогрессирующих личностных расстройств.
Степень поражения органа определяют при проведении ультразвуковой диагностики желчного пузыря и печени, МРТ и КТ. Исследования демонстрируют изменение размеров органа, очаги отмирания и атрофии.
Причину патологии обнаруживают, выполнив биопсию. Обычно ее выполняют под контролем УЗИ, т. к. процедура при циррозе может быть опасной.
Справочно. Электроэнцефалограмма позволит оценить, насколько поражен головной мозг. В некоторых случаях берут пункцию спинномозговой жидкости для проверки уровня белка.
Также, данный диагноз следует подозревать у пациентов с сонливостью, заторможенной реакцией, речевыми нарушениями, неадекватным поведением при наличии у них специфических признаков хронического поражения печени:
- печеночных звездочек на кожных покровах;
- желтухи;
- выпадения волос;
- истощения
- вздутия живота и постоянной тошноты;
- уменьшения печени в размерах и увеличении селезенки;
- снижения либидо;
- появление «головы медузы»;
- выявление специфических биохимических отклонений в анализах крови.
По показаниям (как правило, при острых ПЭ), проводят исследования на яды и токсины, тест на содержание алкоголя в крови.
Также, в обязательном порядке, выполняют общие и биохимические диагностики, ультразвуковое исследование печени, печеночную биопсию (по показаниям).
Часто используемым тестом при печеночной энцефалопатии, позволяющим оценить степень прогрессирования патологии, является тест Рейтана, основанный на соединении чисел.
Осложнения
На фоне печеночной энцефалопатии могут возникать другие заболевания:
- Отек головного мозга. При печеночной энцефалопатии нарушается водный баланс в организме, жидкость скапливается в тканях органов, в том числе головного мозга.
- Кровотечения. При энцефалопатии нарушается работа органов ЖКТ и выработка собственных ферментов. Это может привести к обострению хронических заболеваний, желудочному или кишечному кровотечению, которое необходимо срочно остановить. Желудочное кровотечение часто выражается в виде рвоты по типу кофейной гущи, черным калом.
- Инфекции. При печеночной энцефалопатии организм ослабевает, иммунитет падает, поэтому велика вероятность присоединения различных инфекций, которые усугубляют течение болезни.
- Аспирационная пневмония. Если больной находится в тяжелом состоянии и длительное время лежит, иногда происходит попадание содержимого желудка в легкие, что и вызывает воспалительный процесс.
- Острый панкреатит. Панкреатит при печеночной энцефалопатии встречается часто. Воспаление в тканях железы развивается очень быстро и приводит к сильной боли в животе, тошноте и продолжительной рвоте желчью, повышению температуры, желтухе.
На стадии проявления осложнений больного госпитализируют. Обычно все перечисленные последствия появляются на 3-4 стадии заболевания, когда поражение мозга и других органов значительно.
Первая помощь
Неотложная помощь должна быть оказана больному при проявлении симптомов печеночной комы. Нужно:
- зафиксировать начало приступа и сообщить его врачу;
- уложить человека на бок;
- проветрить помещение;
- очистить рот от рвоты;
- давать постоянно чистую воду.
При чрезмерном возбуждении показана инъекция однопроцентного Димедрола в объеме 2 мл. Для нормализации сердечно-сосудистой деятельности делают укол Кордиамина или Метазона.
Лекарственные средства
| Наименование | Действие | Правила приема | Стоимость |
| Нормазе | Слабительное средство, активизирующее работу кишечника, позволяющее вывести из организма накопившиеся остатки каловых масс и токсины. | Для детей до 12 лет – 15 мл. средства 1 раз в сутки, для взрослых – 40 мл. в день. Курс – 5 дней. | 280 руб. за 1 флакон. |
| Канамицин | Препарат в виде порошка для приготовления растворов (используют для внутривенного или внутримышечного введения). Оказывает противомикробное действие, снижает активность патогенной микрофлоры (вирусы, грибки, анаэробные формы). | Суточная доза – 2-3 грамма, разведенные в 1 л. воды. Принимать 1 раз в 6 часов. Курс – определяется индивидуально. | 15 руб. за 1 гр. |
| Гепа — Мерц | Саше для приготовления раствора. Помогает защитить клетки печени, вывести токсины из ее тканей. | Суточная доза 20-40 гр. средства. Использовать равными дозами 4 раза в сутки. Длительность – до 10 дней. | 750 руб. за 10 саше по 5 гр. |
| Гордокс | Препарат в форме ампул используется при угрозе развития внутренних кровотечений, а также во время хирургических операций. | Средство предназначено для внутривенного введения. Раствор вводят в количестве 5-10 мл. в минуту. Продолжительность терапии определяется индивидуально. | Около 4900 руб. |
Лечение печеночной энцефалопатии
Все препараты при печеночной энцефалопатии должны назначаться исключительно врачом. Самолечение и применение методов народной терапии — недопустимы.
Справочно. Диета при печеночной энцефалопатии является одним из важнейших этапов лечения.
Пациентам подбирается безбелковый (в периоды обострений) или малобелковый рацион. Однако, при минимальных проявлениях заболевания диету расширяют. Это связано с тем, что чрезмерно сниженное употребления белковой пищи приводит к истощению пациента и развитию отрицательного азотистого баланса.
В связи с этим, степень ограничения белков напрямую зависит от выраженности проявлений ПЭ.
При нормализации неврологического статуса проводится постепенное расширение диеты, с целью профилактики развития истощения и анорексии.
Необходимо учитывать, что в диете отдается предпочтение белкам растительного происхождения, так как в растительной пище содержится много волокон, клетчатки. Также растительная пища практически не содержит ароматические аминокислоты.
Медикаментозное лечение в обязательном порядке включат в себя назначение лактулозы (Дюфалак). Данное вещество способствует закислению кишечного содержимого и активному подавлению роста патогенной и условно-патогенной кишечной микрофлоры, что приводит к снижению синтезирования аммиачных соединений.
Дозировки подбираются индивидуально. Назначенные дозировки считаются адекватными, если у пациента наблюдается полужидкий стул от двух до четырех раз в сутки. При появлении диареи, болей в животе, вздутия живота дозировки снижают.
Пациентам, находящимся в тяжелом состоянии, лактулоза назначается через назогастральные зонды.
Справочно. Также, с целью угнетения размножения патогенной и условно-патогенной кишечной микрофлоры, рекомендовано назначение антибиотиков. Чаще всего используются препараты неомицина, метронидазола, ванкомицина.
Наиболее эффективным препаратом является производное рифампицина Рифаксимин (антибактериальное средство из класса ансамицинов, отличающееся широчайшим спектром противомикробного воздействия).
Дозировки антибактериальных средств и кратность приема подбираются индивидуально.
Использование противомикробных лекарственных средств способствует подавлению избыточного роста кишечной микрофлоры и снижению синтеза аммиака.
С целью выведения аммиачных соединений из кровотока применяют препараты L–орнитинов — L–аспартатов. Также, с целью угнетения поступления в головной мозг ложных нейромедиаторных веществ могут применяться аминокислоты, отличающиеся разветвленными цепями (рекомендовано применение лейцинов, валинов, изолейцинов).
Хирургическое вмешательство
Основными способами оперативного лечения являются:
- Портовакальное шунтирование. Устанавливается шунт для обеспечения обходного кровотока. В результате этого уменьшается давление крови в воротной вене, снижается вероятность гипертензии в местных сосудах, обеспечивается стабильное кровоснабжение.
- Пересадка органа. Выполняется, если печеночная патология носит необратимый характер, а медикаментозное лечение неэффективно.
Почему развивается болезнь?
Сказать точно, почему развивается печеночная энцефалопатия, ученые до сих пор не могут. Существует три теории, объясняющие, почему при отмирании ткани печени нарушается деятельность мозга, и каждая из них имеет убедительные доказательства:
- Теория ложных нейротрансмиттеров. Она говорит о том, что при печеночной недостаточности повышается гниение белка в толстом кишечнике. Организм пытается использовать некоторые аминокислоты – те, что имеют строение с разветвленной цепью (лейцин, валин, изолейцин) – в качестве энергии. В результате в кровь поступают ароматические аминокислоты (фенилаланин, тирозин, триптофан), которые в норме должны проходить метаболизм в печени. Они доходят до мозга и стимулируют образование передающих веществ, которых там не должно быть (ложные нейротрансмиттеры). Это тормозит систему ферментов, которые должны превращать тирозин в диоксифенилаланин (из него получаются дофамин и норадреналин). Также в мозге накапливаются тормозящие его работу фенилэтиламин, октопаннин, тиронин. Это диктует необходимость прекращения поступления белкового питания, замещением его введением только сбалансированных смесей, состоящих из правильных аминокислот.
- Токсическая (аммиачная) теория. Она говорит о том, что работа мозга ухудшается из-за токсинов (в первую очередь, аммиака и продуктов гниения белка), образующихся в большей мере в толстой кишке, а также в мышцах, в тонкой кишке и в печени – при расщеплении в ней белков. Организм всегда старается поддерживать баланс между образованием и обезвреживанием аммиака, но если этого не происходит, токсины поступают по воротной вене в печень. Там аммиак должен был бы включиться в цикл реакций под названием «орнитиновый цикл», чтобы из него получилась мочевина. Но поскольку печеночные клетки повреждены, то скорость обезвреживания токсинов и аммиака сильно замедлены. Они, вместе с теми веществами, которые миновали печень и попали сразу в нижнюю полую вену, и являются токсичными для мозга веществами. Улучшить ситуацию могут «правильные» аминокислоты, которые ведут обезвреживание аммиака «в обход» орнитинового цикла – а по пути образования из него глутамина. Это аргинин, глутаминовая кислота, орнитин и аспартат. Они превращают аммиак в нетоксичный для мозга глутамин.
- Гипотеза нейроглии (так называется ткань, являющаяся в головном мозге вспомогательной). Она говорит о том, что появляющиеся при печеночной недостаточности токсины, а также нарушение баланса аминокислот, приводят к отеку нейроглии и нарушению ее функционирования. Но если при циррозе или фиброзе печени токсичные для мозга соединения образуются в кишечнике, то при острых гепатитах, вызванных различными вирусами, они являются продуктами разрушения печени.
Факторы риска
Острое или хроническое поражение печени, приводящее к повреждению мозговой ткани, провоцируются такими факторами:
- печеночная недостаточность;
- вирусный, алкогольный гепатит;
- злоупотребление лекарствами;
- цирроз печени;
- гепатоцеллюлярная карцинома;
- дисбактериоз кишечника;
- злоупотребление белковой пищей;
- фиброз печени;
- алкогольная зависимость;
- частые запоры;
- глистные инвазии;
- желчнокаменная болезнь;
- аутоиммунные нарушения;
- перитонит на фоне брюшной водянки;
- послеоперационные осложнения;
- инфекционные болезни;
- кровотечения из желудка.
Энцефалопатия появляется при патологических состояниях, которые сопровождаются гепатоцитолизом – массовой гибелью печеночных клеток (гепатоцитов).
Профилактика
Предотвратить печеночную энцефалопатию, уменьшить остроту ее течения помогут профилактические меры. Они включают:
- рациональную диету с ограниченным приемом белка;
- отказ от бесконтрольного приема лекарств;
- своевременное лечение заболеваний печени;
- прекращение приема алкоголя;
- использование фосфатных клизм для очистки кишечника;
- своевременное лечение запоров.
Печеночная энцефалопатия имеет негативный прогноз, если больной будет игнорировать ее симптомы и откажется от своевременной диагностики и лечения.
Она оказывает влияние на все сферы личности человека и его жизни. Правильно назначенная терапия и соблюдение мер профилактики поможет улучшить прогноз и качество жизни больного.
Факторы риска
Основными причинами развития опасного состояния являются такие факторы как:
- Гепатиты различных видов (чаще всего, это гепатиты В и Д, реже – С и А, во время беременности влияние оказывает вирус гепатита Е);
- Другие инфекционные заболевания печени, протекающие в острой форме (герпес, ветрянка);
- Грибковые инфекции, поражающие ткани органа;
- Наличие абсцессов в тканях печени;
- Гнойные заболевания печени и желчного пузыря;
- Пищевое отравление (например, при употреблении в пищу ядовитых грибов, таких как бледная поганка, мухомор);
- Продолжительное негативное воздействие токсичных веществ (например, этиловый спирт, соединения хлора);
- Бесконтрольный прием лекарственных препаратов (антибиотики, гормональные средства, препараты на основе ацетилсалициловой кислоты, фторотановые анестезирующие средства);
- Нарушения метаболических процессов, приводящие к накоплению меди в тканях органа;
- Повреждение крупных сосудов печени;
- Онкологические заболевания и использование сильнодействующих химических препаратов для их терапии;
- Систематическое употребление алкоголя;
- Аутоиммунные патологии.
По поводу методов лечения и соблюдения диеты рекомендуем ознакомиться с комментариями врача Государственного медицинского центра им. А.И. Бурназяна ФМБА по конкретному диагнозу пациента (мужчина 37 лет): https://health.mail.ru/consultation/531687/.
Как предупредить заболевание
Энцефалопатия провоцируется множеством факторов, поэтому специфической профилактики болезни не существует. Чтобы снизить риск повреждения мозга, рекомендуется:
- рационально питаться;
- вести активный образ жизни;
- отказаться от гепатотоксических лекарств;
- вовремя лечить печеночные болезни.
Отказ от алкоголя и сбалансированное питание снижают нагрузку на печень. Предупреждение массовой гибели печеночных клеток уменьшает риск нарушения обезвреживающей функции органа.
Печеночная энцефалопатия (ПЭ), или портосистемная энцефалопатия, — это потенциально обратимый синдром нарушения функций головного мозга у больных с прогрессирующей печеночной недостаточностью. Однако П.Э. не является единой категорией и может отражать клинические проявления обратимой метаболической энцефалопатии, атрофии головного мозга в результате гепатоцеребральной дистрофии, отека мозга, либо любую комбинацию этих состояний. Механизмы, нарушающие функции головного мозга при печеночной недостаточности, до сих пор полностью не изучены, однако ясно, что они напрямую связаны с печеночной недостаточностью и нарушением обмена аммиака. Если основное заболевание печени не поддается лечению, ПЭ ассоциируется с плохой выживаемостью и высоким риском рецидива [1, 2]. Даже в самой мягкой форме ПЭ снижает качество жизни, обусловленное состоянием здоровья, и является фактором риска эпизодов тяжелой ПЭ [3, 4].
Патогенез
Несмотря на более чем 100-летниюю историю исследований, патогенез ПЭ до сих пор не совсем ясен. В основном это связано с трудностями изучения головного мозга пациентов с ПЭ in vivo
. Большинство опубликованных данных получены из экспериментальных моделей ПЭ, которые далеки от совершенства. Наиболее распространенные гипотезы патогенеза отражают роль нейротоксинов, нарушение нейротрансмиссии вследствие метаболических нарушений при печеночной недостаточности, изменение энергетического метаболизма мозга, аминокислотный дисбаланс, системный воспалительный ответ и нарушения проницаемости гематоэнцефалического барьера [5—7]. Различные гипотезы патогенеза ПЭ не являются взаимоисключающими. Вероятно, что многие из описанных нарушений могут воздействовать одновременно и в конечном итоге приводить к развитию ПЭ.
Нейротоксины.
Наиболее изученным нейротоксином, связанным с ПЭ, является аммиак, который образуется главным образом в желудочно-кишечном тракте и по воротной вене поступает в печень. Здоровая печень обезвреживает поступающий в нее аммиак путем преобразования в глутамин, тем самым предотвращая его проникновение в системный кровоток. При прогрессирующих заболеваниях печени увеличение концентрации аммиака в крови происходит как вследствие нарушения его преобразования печенью в глутамин, так и в результате порто-системного шунтирования, при котором кровь, минуя печень, поступает в системный кровоток [3].
При повышении концентрации аммиака в крови он проникает через гематоэнцефалический барьер и оказывает нейротоксический эффект прежде всего на астроциты, наиболее многочисленные клетки головного мозга, тесно связанные с функционированием нейронов. Ключевым механизмом развития ПЭ является отек астроцитов вследствие гипераммониемии [8—11].
Избыток аммиака приводит к накоплению образующегося в астроцитах глутамина, что сопровождается увеличением внутриклеточной осмолярности и в больших концентрациях вызывает отек мозга [12].
Нарушение нейротрансмиссии.
В патогенезе ПЭ важную роль играют нарушения функционирования нейротрансмиттеров коры головного мозга и их рецепторов. В экспериментальных моделях печеночной недостаточности изучались нарушения нескольких нейромедиаторных систем. В большинстве этих работ описаны изменения в ГАМКергической нейромедиаторной системе, допаминергических, серотонинергических и глутаматергических нейротрансмиттерных системах [13, 14]. В частности, роль ГАМКергических влияний в развитии ПЭ может быть связана с активацией бензодиазепиновых рецепторов головного мозга и связанным с этим увеличением синтеза нейростероидов [15].
Аминокислотный дисбаланс.
Важную роль в патогенезе ПЭ играет аминокислотный дисбаланс в виде увеличения уровня ароматических аминокислот (тирозина, фенилаланина, триптофана), являющихся предшественниками ложных нейротрансмиттеров, и снижением содержания аминокислот с разветвленной цепью (валина, лейцина, изолейцина). В этих условиях происходит избыточное поступление в головной мозг ароматических аминокислот, которые служат исходным продуктом для синтеза ложных нейротрансмиттеров. Эти сдвиги в составе аминокислот также сопровождаются снижением синтеза допамина, что также способствует образованию ложных нейротрансмиттеров [16].
Клиника
Клиническая картина при ПЭ представляет собой широкий спектр неспецифических неврологических и психических нарушений [17]. Признаки энцефалопатии у пациентов с хроническими заболеваниями печени зависят от этиологии основного заболевания, характера и тяжести патогенных факторов.
Выраженность ПЭ варьирует от латентной (0 стадия) и легкой степени (I стадия) до комы (IV стадия). При минимальной ПЭ она проявляется преимущественно нарушениями абстрактного мышления и общим негрубым снижением когнитивных функций без нарушений памяти, интеллекта, речи, способности к обучению, которые остаются сохранными в течение длительного времени [18, 19]. У некоторых больных с печеночной недостаточностью в течение ряда лет выявляют лишь нарушения высших функций мозга без какой-либо иной неврологической симптоматики [20].
По мере прогрессирования ПЭ нарастают изменения личности, такие как апатия, раздражительность и снижение контроля над поведением, а также появляются явные изменения в сознании и двигательной функции [21]. Часто наблюдаются нарушения цикла сна и бодрствования с чрезмерной сонливостью в дневное время, хотя полное нарушение цикла сна и бодрствования обычно отсутствует [22—24]. С нарастанием печеночной недостаточности развивается прогрессирующая дезориентация во времени и пространстве, нарушение поведения, возникают эпизоды спутанности сознания с возбуждением или сонливостью, ступор и, наконец, кома [25]. В консенсусе Международного общества по печеночной энцефалопатии и азотистому обмену (International Society for Hepatic Encephalopathy and Nitrogen Metabolism — ISHEN) появление дезориентации или астериксиса («хлопающего» тремора) рассматривают как начальные признаки явной ПЭ [26].
У некоматозных пациентов с ПЭ наблюдают нарушение двигательных функций, такие как мышечную гипертонию, гиперрефлексию и положительный рефлекс Бабинского. С развитием комы глубокие сухожильные рефлексы обычно уменьшаются [27] и даже исчезают, хотя пирамидные знаки могут сохраняться. Иногда может возникать очаговый неврологический дефицит [28]. Судороги при ПЭ наблюдаются очень редко [29—31].
Частыми проявлениями заболевания являются экстрапирамидные нарушения в виде гипомимии лица, ригидности мышц, брадикинезии, гипокинезии, монотонности и замедления речи, паркинсоноподобного тремора и дискинезия с ограничением произвольных движений [27].
Астериксис («хлопающий тремор») часто отмечают в начальных и средних стадиях ПЭ, которые предшествуют ступору или коме. В действительности он является не тремором, а отрицательным миоклонусом и вызывается гиперэкстензией запястья пациента с разведенными пальцами. Примечательно, что психические и моторные нарушения при ПЭ могут быть выражены незначительно или не прогрессируют одинаково у разных пациентов, что приводит к трудностям в определении стадии ПЭ.
Классификация
Согласно практическим рекомендациям Американской ассоциации изучения болезней печени и Европейской ассоциации по изучению печени [32] ПЭ классифицируют по четырем признакам: в зависимости от причин, которые привели к ее развитию; по длительности и характеру течения; по тяжести течения (стадиям) и в зависимости от наличия провоцирующих (триггерных) факторов.
А — печеночная энцефалопатия в результате острой печеночной недостаточности;
В — портосистемное шунтирование в отсутствие цирроза печени (ЦП);
С — печеночная энцефалопатия у больных, страдающих циррозом.
Классификация ПЭ по длительности и характеру течения:
1) эпизодическая ПЭ;
2) рецидивирующая ПЭ — это приступы ПЭ, которые происходят с временным интервалом 6 мес или меньше;
3) персистирующая ПЭ представляет поведенческие нарушения, которые присутствуют постоянно и перемежаются с рецидивами явной ПЭ.
Классификация тяжести течения ПЭ по стадиям (шкала West Haven)
I. Минимальная (латентная) стадия: отчетливая клиническая симптоматика отсутствует, но отмечается нарушение стандартизированных психомоторных тестов (теста связи чисел, теста линии).
II. Первая (легкая) стадия: апатия, возбуждение, раздражительность, беспокойство, эйфория, быстрая утомляемость, нарушения ритма сна и бодрствования, легкий тремор, нарушение координации движений, астериксис.
III. Вторая (средняя) стадия: сонливость, летаргия, дезориентация во времени и пространстве, неадекватность поведения, астериксис, дизартрия, атаксия.
IV. Третья (тяжелая) стадия: сопор, выраженная дезориентация, нечеткая речь, гиперрефлексия, наличие патологических рефлексов (Гордона, Жуковского), миоклония, гипервентиляция.
V. Четвертая стадия: печеночная кома, децеребрационная ригидность, окулоцефалический феномен, отсутствие ответа на любые раздражители.
В зависимости от наличия провоцирующих (триггерных) факторов ПЭ подразделяют на непровоцируемую и провоцируемую (в данном случае должен быть указан провоцирующий фактор). Провоцирующие факторы (инфекции, желудочно-кишечное кровотечение, передозировка диуретиков, электролитные нарушения, запор) целесообразно выявлять для всех эпизодов ПЭ типа С и устранять в случае их наличия.
Диагностика
Диагностика явной ПЭ
Диагноз явной ПЭ основан на объективном клиническом обследовании. Оно предусматривает оценку симптомов ПЭ, а также исключение других причин нарушения функции головного мозга. В клинической картине у пациентов с явной ПЭ имеются симптомы заболеваний гепатобилиарной системы, например у большинства больных развитию ПЭ предшествует желтуха. Часто у пациентов с энцефалопатией можно выявить «печеночный» запах и гипервентиляцию [33]. Также диагноз ПЭ подтверждается выявлением провоцирующих факторов (инфекции, кровотечения и запоры и т. д.).
«Золотым стандартом» диагностики явной ПЭ являются критерии West-Haven, однако они имеют ограниченную диагностическую ценность из-за субъективности оценок, особенно при ПЭ I стадии, так как легкая гипокинезия, психомоторная заторможенность и рассеянность могут быть пропущены при клиническом осмотре. Ведущими диагностическими симптомами явной ПЭ является наличие у пациента дезориентации и астериксиса [32].
Для описания состояния пациентов со значительно измененным сознанием рекомендуется использовать шкалу оценки глубины комы Глазго (Glasgow Coma Scale — GCS). Шкала Глазго предусматривает подсчет баллов, отражающих выраженность реакции больного на раздражители. Определяют способность к открыванию глаз, характер двигательной и вербальной реакций на простые стимулы (голосовое обращение и боль). Коме предшествуют менее глубокие формы угнетения сознания: спутанность сознания, сопор и ступор.
Диагностика минимальной ПЭ
Минимальная ПЭ определяется как нарушения функций головного мозга, выявляемое с помощью тестов у пациентов с хроническим заболеванием печени, у которых нет дезориентации или не развился астериксис. Обследование таких пациентов может включать два основных вида тестов: психометрические и нейрофизиологические. ISHEN рекомендует использовать по крайней мере два теста, в зависимости от их доступности и местных условий. Важность тестирования на наличие минимальной ПЭ заключается в том, что это позволяет прогнозировать развитие явной ПЭ.
Для диагностики минимальной ПЭ рекомендуется проведение нейрофизиологических и психометрических тестов, среди которых наибольшую значимость имеют как простые, выполняемые на бумаге при помощи ручки (психометрическая шкала ПЭ), так и компьютеризированные (тест задержки времени реакции, тест Струпа, тест ингибиторного контроля и SCAN-тест) и нейрофизиологические (тест критической частоты слияния мельканий) тесты [32]. Электроэнцефалография позволяет выявлять изменения в корковой активности мозга при ПЭ, однако этот метод недостаточно специфичен, так как на него могут влиять сопутствующие метаболические нарушения и прием лекарственных средств.
Лабораторные тесты.
У пациентов с ПЭ выявляются сывороточно-биохимические печеночные синдромы различной степени выраженности в зависимости от преимущественной направленности патологических процессов в печени [34].
Синдром цитолиза, или синдром повреждения гепатоцитов (нарушение целостности, некроз гепатоцитов), характеризуется прежде всего повышением аминотрансфераз (аспартат- и аланинаминотрансфераза), а также других ферментов — лактатдегидрогеназы-5, альдолазы, орнитинкарбамилтрансферазы, сорбитдегидрогеназы, глутаматдегидрогеназы.
Синдром холестаза характеризуется повышением билирубина, главным образом, конъюгированного (прямого), щелочной фосфатазы, гамма-глутамилтранспептидазы, 5-нуклеотидазы, холестерина и желчных кислот.
Синдром воспаления характеризуется повышенным содержанием различных фракций глобулинов, диспротеинемией, повышением содержания сывороточных иммуноглобулинов.
В рекомендациях AASLD/EASL [32] отмечается, что у пациентов с хроническим заболеванием печени диагностическую или прогностическую ценность имеет только высокий уровень аммиака в крови. Однако если содержание аммиака находится в пределах нормальных значений, диагноз ПЭ вызывает сомнения. Повторные измерения уровня аммиака могут применяться для оценки эффективности лечения в случаях приема пациентами лекарств, снижающих уровень аммиака.
Компьютерная или магнитно-резонансная томография и другие методы визуальной диагностики не дают полной диагностической информации и имеют ограниченную ценность. В основном они используются для исключения структурных повреждений головного мозга у больных ЦП.
Дифференциальный диагноз
Рекомендации AASLD/EASL указывают на необходимость исключения других заболеваний, которые могут напоминать ПЭ [32]:
1) сахарный диабет (гипогликемическая, гипергликемическая и гиперосмолярная комы, лактатацидоз);
2) злоупотребление алкоголем (интоксикация, синдром отмены, синдром Вернике);
3) передозировка лекарственных препаратов (бензо-диазепинов, нейролептиков, опиоидов);
4) нейроинфекции и электролитные нарушения (гипонатриемия, гиперкальциемия);
5) бессудорожная эпилепсия, психические заболевания;
6) внутримозговое кровоизлияние и ишемический инсульт;
7) деменция (первичная и вторичная);
 повреждение головного мозга (травматическое, неопластическое, нормотензивная гидроцефалия, синдром обструктивного апноэ сна).
повреждение головного мозга (травматическое, неопластическое, нормотензивная гидроцефалия, синдром обструктивного апноэ сна).
Лечение
Лечение ПЭ включает устранение провоцирующих факторов, диетические мероприятия и медикаментозную терапию. Устранение провоцирующих факторов является первоочередной задачей в лечении явной ПЭ, поскольку у 90% пациентов этого оказывается достаточно для улучшения состояния [32].
Диета
Коррекция нарушений белково-азотистого обмена имеет решающее значение в лечении всех степеней ПЭ, так как у 75% пациентов с ПЭ имеется белково-калорийная недостаточность средней или тяжелой степени, сопровождающаяся потерей мышечной массы. Длительное ограничение потребления белка вредно для больных ПЭ, так как потребность в белке у этих пациентов относительно выше, чем у здоровых лиц.
Поэтому, согласно рекомендациям AASLD/EASL, суточное потребление энергии следует поддерживать на уровне 35—40 ккал на 1 кг массы тела, а ежедневное потребление белка — в пределах 1,2—1,5 г/кг [32]. Ограничение потребления белка рекомендуется только в течение первых нескольких дней с момента развития ПЭ, но потом от этой меры следует отказаться. Белки животного происхождения следует замещать молочным и растительным белком, а также потреблять пищу, обогащенную аминокислотами с разветвленной боковой цепью.
Медикаментозная терапия
Медикаментозная терапия является важной частью лечения явной П.Э. При минимальной ПЭ в отсутствие ее клинических проявлений фармакотерапия, как правило, не применяется. В то же время она может назначаться этой категории пациентов в случаях заметного влияния минимальной ПЭ на качество жизни. Для коррекции ПЭ могут использоваться различные лекарственные средства (невсасывающиеся дисахариды, антибиотики, аминокислоты с разветвленной боковой цепью, L-орнитин- L-аспартат) с разным уровнем доказательств эффективности.
Невсасывающиеся дисахариды.
Лактулоза — синтетический дисахарид, который препятствует образованию аммиака. Лактулоза является препаратом первого выбора в лечении явной П.Э. Сироп лактулозы назначают по 25 мл каждые 1—2 ч до появления по крайней мере 2 дефекаций мягким или неоформленным стулом на протяжении суток. В дальнейшем доза препарата титруется индивидуально для поддержания 2- или 3-кратного опорожнения кишечника в течение суток [35]. Прием чрезмерно высоких доз лактулозы может привести к таким осложнениям, как аспирация, дегидратация, гипернатриемия, раздражение перианальных кожных покровов, а в некоторых случаях даже усугубить течение ПЭ [36].
Антибиотики.
Рифаксимин — невсасывающийся антибиотик, угнетающий аммониегенную протеолитическую бактериальную микрофлору кишечника [37]. Результаты ряда исследований показали эффективность рифаксимина в лечении П.Э. Согласно рекомендациям AASLD/EASL [32], рифаксимин является эффективным дополнением к лактулозе для профилактики рецидива явной ПЭ. В сравнительных исследованиях 3—6-месячная терапия рифаксимином способствовала улучшению когнитивных функций и снижению уровня аммониемии у пациентов с ПЭ [38]. Рифаксимин назначают в дозе 200—400 мг 2—3 раза/сут (1200 мг/сут) в течение 5—7 (до 14) дней.
Из других антибиотиков для лечения ПЭ по-прежнему применяется неомицин, для краткосрочной терапии может использоваться метронидазол, однако из-за побочных эффектов долгосрочное применение этих препаратов ограничено [39, 40].
Аминокислоты с разветвленными цепями.
В ряде исследований показана эффективность лечебного питания с потреблением пищи, обогащенной аминокислотами с разветвленной боковой цепью [15]. Благодаря преимущественному усвоению этих аминокислот, уменьшается относительное содержание ароматических аминокислот, служащих предшественниками ложных нейромедиаторов. Кроме того, аминокислоты с разветвленной боковой цепью способствуют увеличению мышечной массы, в результате чего усиливается детоксикация аммиака, которая частично происходит в скелетной мускулатуре. Рекомендации AASLD/EASL предусматривают только пероральный прием аминокислот с разветвленными цепями в качестве альтернативного или дополнительного средства лечения пациентов, не ответивших на традиционную терапию [41, 42].
L-орнитин-L-аспартат (LOLA).
Так как орнитин и аспартат играют основную роль в превращении аммиака в мочевину, прием LOLA способствует уменьшению клинических проявлении ПЭ. В течение последних 10 лет проведено несколько рандомизированных исследований, результаты которых показали высокую эффективность и безопасность применения этого препарата в лечении ПЭ [43]. LOLA выпускается в виде раствора для внутривенной инфузии и в форме гранулята для перорального приема. Стандартная схема применения предусматривает внутривенное капельное введение 20—30 г препарата в течение 7—14 дней с последующим переходом на пероральный прием 9—18 г/сут. Для достижения более быстрого и стойкого результата возможна комбинация внутривенного и перорального способов введения.
Флумазенил
— антагонист бензодиазепиновых рецепторов, непосредственно воздействующий на функции центральной нервной системы. Флумазенил применяется довольно редко, так как давая кратковременный эффект восстановления сознания, способствует лишь транзиторному улучшению психического состояния, но не влияет на выздоровление и показатели выживаемости [15].
Эффективность проводимой терапии определяется по обратному развитию клинической симптоматики.
При острой печеночной недостаточности с развитием печеночной комы и отека мозга лечение проводят в отделении интенсивной терапии с использованием тех же фармакопрепаратов, что и при хронической печеночной недостаточности, но в более высоких дозах.
Трансплантация печени при циррозе с рецидивирующей, плохо поддающейся консервативной терапии ПЭ позволяет увеличить продолжительность жизни больных. Средняя 5-летняя выживаемость больных после трансплантации превышает 72% [15].
Авторы заявляют об отсутствии конфликта интересов.