Быстрый переход Лечение первичного иммунодефицита
Первичный иммунодефицит (ПИД) — это гетерогенная группа редких, преимущественно наследственных заболеваний, характеризующихся нарушением работы одного или нескольких компонентов иммунной системы.
Такие нарушения иммунитета приводят к повышенной уязвимости организма к различным патогенам, выражающейся в частых и рецидивирующих инфекционных заболеваниях, развитии хронических и системных болезней (аутоиммунных, онкологических).
Классификация иммунодефицитных состояний
По происхождению все иммунодефицитные состояния делят на три основные группы:
1. Физиологические.
2. Первичные иммунодефицитные состояния. Могут быть врожденными или наследственными. Первичные иммунодефицитные состояния возникают в результате генетического дефекта, под влиянием которого нарушаются процессы функционирования клеток иммунной системы человеческого организма.
3. Вторичные иммунодефицитные состояния (приобретенные после рождения, в процессе жизнедеятельности). Развиваются под влиянием различных биологических и физических факторов.
По преимущественному повреждению клеток иммунной системы организма иммунодефицитные состояния делят на 4 группы:
- с повреждением гуморального иммунитета (гуморальные, В-зависимые);
- с повреждением клеточного иммунитета (клеточные, Т-зависимые);
- с поражением фагоцитоза (А-зависимые);
- комбинированные (когда поражаются звенья как гуморального, так и клеточного иммунитета).
Вторичный иммунодефицит
Вторичные иммунодефицита возникают у животных в постнатальном периоде под влиянием многочисленных иммунодепрессантов.
Иммунодепрессивные заболевания характеризуются чаще вcero нарушением генеза и функций иммуноцитов и неспецифических факторов защиты. Связь между состоянием иммунной системы и патогенным агентом носит весьма сложный характер. Вторичные иммунодефицита могут быть результатом неполноценного питания животных, инфекций и инвазий, неблагоприятных условий содержания, воздействия химических и цитотоксических веществ, физических факторов, болезней обмена веществ и многих других причин.
Бактериальные и вирусные инфекции могут быть как следствием, так и причиной вторичных иммунодефицитов.
При острых инфекционных заболеваниях (вирусный гепатит, паратиф, чума, парагрипп и др.) как у человека, так и у животных иммунодефицитные состояния имеют общие закономерности: у подавляющего большинства больных прежде всего страдает Т-система иммунитета со снижением репродукции Т-активных клеток-хелперов, нарушением дифференцировки популяций, снижением гиперчувствительности замедленного типа.
В меньшей степени поражается В-система иммунитета.
Выявлено, что при сочетании двух и более инфекционных заболеваний иммунодефицит более резкий, чем при моноинфекции. При развитии иммунодефицита на фоне уже имевшегося врожденного или приобретенного иммуннодефицита показатели иммунитета и неспецифических факторов защиты снижаются до минимума, заболевание приобретает тяжелое течение с нередким летальным исходом.
Особый интерес к состоянию резистентности организма и вторичному иммунодефициту проявляют исследователи вирусных инфекций сельскохозяйственных животных.
Так, установлен факт давления клеточного звена иммунитета при парагриппе, чуме иней, инфекционной анемии лошадей, чуме собак, болезни Марека у птиц. При болезни Ауески ингибирована миграция макрофагов, ослаблена гиперчувствительность замедленного типа, поражена Т-система иммунитета.
Для африканской чумы свиней характерны повышенная бласттрансформация, торможение миграциии лейкоцитов, усиленный антителозависимый цитолиз; при вирусном гастроэнтерите телят подавлен антителогенез; при трансмиссивном гастроэнтерите свиней заторможена пролиферация лейкоцитов.
Выявлено, что многие вирусы — возбудители инфекционных болезней обладают тропизмом к лимфоидным клеткам, прежде то к макрофагам, что обеспечивает их размножение и диссеминацию. Взаимодействие вирусов с лимфоидной тканью играет центральную роль в патогенезе вирусных болезней с системной патологией .
Таким образом, развитие вирусной инфекции различного типа течения или даже поствакцинального процесса в животном организме может существенно менять его иммунный статус, определять вирусиндуцированный иммунодефицит.
Иммунодефицита при гельминтозных и протозойных инвазиях изучались на экспериментальных моделях и у животных разных видов со спонтанно возникавшими болезнями.
В опытах показано, что организм хозяина, инвазированного паразитом, дает сниженный иммунный ответ на гетерологичные антигены. Иммунодепрессивный эффект был установлен при заражении подопытных животных простейшими (Babesia microti, Toxoplasma gondii, Trypanasoma brucei) и гельминтами (Fasciola hepatica, Trichinella spiralis, Schistosoma mansoni).
У зараженных животных была noдавлена выработка антител и ингибирован клеточный иммунитет, который оценивали по отторжению кожных аллотрансплантатов, ответу на кожно-сенсибилизирующие агенты и на митогены Т-клеток.
Механизмы иммунодефицита паразитарной этиологии изучены далеко не полностью. Полагают, что здесь участвуют многочисленные факторы, имеющие место в системах хозяин — паразит. Так, в патогенезе развивающегося вторичного иммунодефицита при паразитозах имеют значение неспецифические супрессорные клетки, обнаруживаемые в селезенке мышей, инвазированных трипаносомами.
Эти клетки способны подавлять ответ нормальных клеток селезенки на митогены как Т-, так и В-клеток. Функции макрофагов животных с экспериментальной малярией существенно нарушены. Они не способны полноценно предъявлять антигены.
Малярия и трипаносомоз сопровождаются резким повышением уровня иммуноглобулинов, из чего делается вывод о поликлональных активаторах лимфоцитов паразитарной природы. Длительная поликлональная активация В-клеток приводит к прогрессирующему то уменьшению антигенчувствительных В-клеток и ослаблению гуморального ответа на гетерологичные антигены.
Экскреторные и секреторные продукты печеночной двуустки цитотоксически действуют на лимфоциты. Сыворотка крови животных, зараженных нематодой Trichinella spiralis, способна агглютинировать, а затем и убивать клетки лимфоузлов. Триптофол, синтезируемый Tripanosoma gambiense, способен угнетать выработку антител у подопытных животных.
Некоторые паразиты ингибируют иммунный ответ, изменяя физиологические функции хозяина. Так, они могут усиливать выработку кортикостероидных гормонов.
В опытах установлено, что введение стероидных препаратов способствует более интенсивному заражению гельминтами. Отмечены даже случаи смертельного исхода после заражения животных Strongyloides stercoralis, получавших кортизон.
При естественно текущей и искусственно вызванной Fasciola hepatica инвазии крупного рогатого скота, при хастилезиозе и желудочно-кишечных стронгилятозах овец, трихинеллезе отмечено угнетение Т-клеточного иммунного ответа.
Инвазия овец Strongyloides papiloides приводит к снижению массы и клеточное-лимфоидных органов, резкой активации Т-супрессоров.
Таким образом, в основе иммунологической недостаточности, вызываемой паразитарной инвазией, лежат самые разнообразные механизмы. Это избыточная активность клеток-супрессоров, наличие общих антигенных детерминант у паразита и хозяина, нарушение функций макрофагов, поликлональная активация В-клеток, паразитарные факторы, угнетающие лимфоцитоз.
Для выявления целостной картины ингибирующего влияния возбудителей паразитарных болезней предстоит выяснить еще многое. Однако уже очевидна повышенная восприимчивость инвазированных животных к инфекциям, вызываемым другими возбудителями. Вакцинация против гетерологичных инфекционных агентов у них может быть менее эффективной. Они более склонны к развитию «спонтанных» опухолей и опу-холей, вызванных вирусами и канцерогенными агентами. Оргазм хозяина утрачивает способность эффективно защищаться против гомологичного паразита.
Этой толерантностью определяется хроническое течение многих инвазионных болезней.
Индуцированная форма ВИН возникает в результате воздействия конкретных причинных факторов: рентгеновского излучения, цитостатической терапии, применения глюкокортикоидов, травмы и хирургических вмешательств.
К этой же группе ВИН относят нарушения иммунитета, развивающиеся вторично по отношению к основному заболеванию (при диабете, заболеваниях печени, почек, злокачественных новообразованиях).
Клинические признаки, позволяющие предполагать наличие ВИН:
• хронические, часто повторяющиеся бронхиты с пневмониями в анамнезе, сочетающиеся с заболеваниями ЛОР-органов (гнойными синуситами, отитами, лимфаденитами);
• часто повторяющиеся пневмонии, бронхоплевропневмонии;
• бронхоэктатическая болезнь;
• бактериальные поражения кожи и подкожной клетчатки (пиодермия, фурункулёз, абсцессы, флегмоны, септические гранулёмы, рецидивирующий парапроктит у взрослых);
• грибковые поражения кожи и слизистых оболочек, кандидоз, паразитарные заболевания;
• афтозные стоматиты в сочетании с повышенной заболеваемостью острыми респираторными вирусными инфекциями;
• рецидивирующая герпесвирусная инфекция различной локализации;
• гастроэнтеропатия с хронической диареей неясной этиологии, дисбактериозом;
• лимфаденопатия, повторные лимфадениты;
• длительный субфебрилитет, лихорадка неясной этиологии;
• генерализованные инфекции (сепсис, гнойные менингиты).
Причины иммунодефицитных состояний
Так как причин нарушения иммунной защиты организма довольно много их условно поделили на несколько групп.
В состав первой группы входят врожденные иммунодефицитные состояния, когда заболевание проявляется сразу после рождения или в раннем детстве.
Во вторую группу входят вторичные иммунодефицитные состояния, причиной возникновения которых могут быть:
- кахексия;
- вирусы краснухи, герпеса, кори;
- продолжительное голодание;
- заражение крови;
- отравление химическими веществами или лекарственными препаратами;
- туберкулез;
- аутоиммунные заболевания;
- наличие в организме пациента паразитов;
- осложнения после оперативного вмешательства;
- ВИЧ;
- пожилой возраст, беременность;
- онкологические заболевания;
- нарушение метаболизма;
- заболевания эндокринных органов;
- большие кровопотери;
- хронический стресс.
Лечение народными средствами: миф ли?
Да, миф. Народные средства для терапии опасного синдрома не приносят должного эффекта, а стимуляция здорового иммунитета «для профилактики» ставится под сомнение. Проведенные исследования показывают, что разрекламированная эхинацея для организма работает только как плацебо. Прельщаться биодобавками на аптечных полках для повышения иммунной защиты не рекомендуется докторами. Лекарственные препараты жизненно необходимы пациентам, которые носят в себе вирус иммунодефицита человека — лечение без них невозможно, но здоровому организму они скорее навредят.
Для борьбы с вредными факторами окружающей среды, требуется не «пуленепробиваемая броня», но система, способная приспосабливаться и самообновляться, приобретая новые навыки. При подозрениях на иммунодефицит, ВИЧ, лечение народными средствами проводить не стоит, нужно сразу же обращаться к врачу.
Симптомы иммунодефицитных состояний
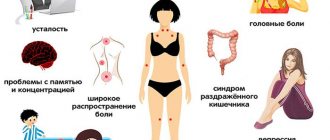
Как приобретенные, так и врожденные иммунодефицитные состояния имеют схожие клинические признаки:
— повышенная восприимчивость к любым инфекциям;
— ломота и боль в мышцах, костях, суставах;
— частые обострения хронических заболеваний (артрозы, артриты, тонзиллит, болезни органов дыхания, ЖКТ и так далее);
— болезненные и увеличенные лимфоузлы;
— сочетание в одном заболевании сразу нескольких патологий различной этиологии (грибковых, бактериальных, вирусных);
— постоянно повышенная температура тела (до 37,7 градусов);
— низкая эффективность от приема антибиотиков;
— общая слабость, беспричинная усталость, вялость, подавленное настроение;
— повышенная потливость.
Помимо клинической картины при постановке диагноза необходимо выявить причину возникновения иммунодефицита. Это нужно для того, чтобы разработать правильную схему лечения и не нанести организму еще больший вред.
Иммунодефицитные состояния у детей
ИДС у детей развиваются в результате поражения одного или сразу нескольких звеньев иммунной защиты организма.
Проявляются иммунодефицитные состояния у детей в виде тяжело протекающих и часто рецидивирующих инфекций. Возможно также развитие опухолей и аутоиммунных проявлений на фоне иммунодефицита.
Некоторые виды ИДС у детей проявляются, в том числе, и в виде аллергии.
Иммунодефицит у детей бывает двух видов: первичный и вторичный. Первичные иммунодефициты вызваны генетическими изменениями и встречаются реже, чем вторичные, причиной которых является внешнее воздействие или какое-либо заболевание.
СПИД (синдром приобретённого иммунного дефицита)
С помощью gp120 (поверхностного гликопротеина) ВИЧ присоединяется к антиген-CD4 рецептору и ко-рецептору, находящихся на поверхностной мембране клеток. Для Т-лимфоцитов ко-рецептором является CXCR-4, а для макрофагов — CCR-5. Клеточные мембраны клетки и вируса сливаются, вирус проникает внутрь клетки, где высвобождается вирусная РНК из капсида и начинается с помощью обратной транскриптазы, копирование двух нитей ДНК на вирусной РНК (обратная транскрипция).
Произведённая ДНК проникает внутрь ядра клетки-хозяина и интегрируется с помощью энзима интегразы в хромосому хозяина. С помощью РНК-полимеразы начинается синтез вирусного генома и информационной РНК вирусных белков (англ. RNA-messenger). С информационной РНК на рибосомах клетки считываются вирусные энзимы и структурные белки.
Синтезированные РНК выходят из ядра клетки в цитоплазму, где начинается образование нового вируса. Вирусный геном упорядочивает фермент — протеаза, а с помощью gp41 и gp120 формируется новая оболочка вируса. Новые вирусные частицы отпочковываются от поверхности клетка, захватывая часть её мембраны, и вирусы выходят в кровяное русло, а CD4+ лимфоцит хозяина погибает.
В период острой фазы ВИЧ-инфекции отсутствие специфического иммунного ответа позволяет вирусу активно реплицироваться и достигать высоких концентраций в крови. Вирус заселяет различные ткани, в первую очередь органы лимфатической системы, и разрушает CD4 лимфоциты.
Кроме CD4-лимфоцитов (хелперов), CD8-лимфоцитов и макрофагов вирус способен инфицировать и другие клетки: альвеолярные макрофаги легких, клетки Лангерганса, фолликулярные дендритные клетки лимфатических узлов, клетки олигодендроглии и астроциты мозга, эпителиальные клетки кишки.
В лимфоидной ткани ВИЧ размножается в течение всей ВИЧ-инфекции, поражая макрофаги, активированные и покоящиеся CD4 лимфоциты, фолликулярные дендритные клетки. Количество клеток, содержащих провирусную ДНК, в лимфоидной ткани в 5-10 раз выше, чем среди клеток крови, а репликация ВИЧ в лимфоидной ткани на 1-2 раза выше, чем в крови. Таким образом, основным резервуаром ВИЧ служат лимфатические узлы.
Кроме того в дендритных клетках лимфатических узлов вирус сохраняется длительное время после периода острой виремии и также является резервуаром инфекции.
Для активации лимфоцитов CD8 и образования антигенспецифических цитотоксических T-лимфоцитов необходимо представление пептидного антигена в комплексе с человеческим лейкоцитарным антигеном класса I (англ. en:Human leukocyte antigen). Дендритные клетки необходимы для начала первичных антигенспецифичных реакций. Они захватывают антигены, перерабатывают и переносят их на свою поверхность, где, в комплексе с дополнительными стимулирующими молекулами, они активируют T-лимфоциты. Зараженные клетки часто не выделяют дополнительных стимулирующих молекул и поэтому не способны вызвать образование достаточного числа клеток ответа (B- и T-лимфоцитов), функция которых зависит от дендритных клеток.
После завершения обратной транскрипции в CD4 лимфоците, вирусный геном представлен провирусной невстроенной ДНК. Для встраивания провирусной ДНК в геном клетки-хозяина, и для образования новых вирусов необходима активация T-лимфоцитов. Контакт лимфоцитов CD4 и антигенпредставляющих клеток в лимфоидной ткани, наличие вирусов на поверхности фолликулярных дендритных клеток и присутствие провоспалительных цитокинов (ИЛ-1, ИЛ-6 и ФНОα) способствует и поддерживает размножению ВИЧ в инфицированных клетках. Поэтому лимфоидная ткань служит самой благоприятной средой для репликации ВИЧ.
Генетические факторы Некоторые генетические факторы могут предохранять от заражения ВИЧ. Так например: Люди имеющие мутации в CCR5 (корецептор М-тропных штаммов вируса) мало или совсем не восприимчивы к М-тропным штаммам ВИЧ-1, но заражаются Т-тропными штаммами.
Гомозиготность по HLA-Bw4 является предохраняющим фактором от прогрессирования болезни. У гетерозигот по локусам HLA класса I иммунодефицит развивается медленнее, чем у гомозигот.
Исследования показали, что у носителей HLA-B14, B27, B51, B57 и C8 инфекция прогрессирует медленнее, а у носителей HLA-A23, B37 и B49 иммунодефицит развивается быстро. У всех ВИЧ-инфицированных с HLA-B35 СПИД развивался не ранее, чем через 8 лет после заражения.
Исследования также показали: у половых партнеров, несовместимых по HLA класса I, риск заражения ВИЧ при гетеросексуальных контактах ниже.
Иммунитет при СПИДе В острой фазе ВИЧ-инфекции, в стадии виремии, происходит резкое снижение CD4+ T-лимфоцитов за счёт прямого лизирующего действия вируса и нарастание числа копий вирусной РНК в крови.
После этого отмечается стабилизация процесса с некоторым увеличением числа CD4 клеток не достигающим, однако, нормальных величин.
Положительная динамика обусловлена увеличением числа цитотоксических CD8+ Т-лимфоцитов. Эти лимфоциты способны уничтожать ВИЧ-инфицированные клетки напрямую путем цитолиза без ограничения по человеческому лейкоцитарному антигену класса I (англ. Human leukocyte antigen-HLA).
Кроме того они секретируют подавляющие факторы (хемокины), такие как RANTES, MIP-1alpha, MIP-1beta, MDC, препятствующие размножению вируса путём блокировки корецепторов.
ВИЧ специфичные CD8+ лимфоциты играют главную роль в контроле острой фазы ВИЧ-инфекции, однако при хроническом течении инфекции не коррелируется с виремией, так как: • Пролиферация и активация лимфоцитов CD8+ зависит от антиген-специфичных T-хелперов CD4. • Лимфоциты CD8+ также могут заражаться ВИЧ, что может вести к снижению их числа.
Синдром приобретённого иммунодефицита является терминальной стадией ВИЧ-инфекции, развивается, у большинства больных, при падении числа CD4+ Т-лимфоцитов, крови ниже 200 клеток/мл (норма CD4+ T-лимфоцитов 1200 клеток/мл).
Депрессию CD4+ клеток при ВИЧ-инфекции объясняют следующими теориями: • Гибель CD4+ T-лимфоцитов в результате прямого цитопатического действия ВИЧ • ВИЧ поражает в первую очередь активированные лимфоциты CD4, а поскольку специфичные к ВИЧ лимфоциты входят в число первых клеток, активируемых в ходе ВИЧ-инфекции, они страдают одними из первых. • Изменение вирусом клеточной мембраны CD4+ T-лимфоцитов, что ведёт их к слиянию между собой с образованием гигантских синцитиев, которое регулируется LFA-1 (англ. Lymphocyte function-associated antigen 1) • Катастрофа CD4 клеток антителами, как результат антител-зависимого цитотоксического действия (англ. ADCC-antibody-dependent cellular cytotoxicity). • Активация естественных клеток-киллеров[49][50]. • Аутоиммунная катастрофа • Связывание белка вируса gp120 с CD4-рецептором (маскировка CD4-рецептора) и как результат — невозможность опознания антигена, невозможность взаимодействия CD4 с HLA класса II. • Запрограммированной клеточной смертью. • Анергия иммунного ответа (греч. Ανεργία — праздность, безделье, англ. Anergy).
B-лимфоциты при ВИЧ-инфекции подвергаются поликлональной активации и выделяют большое количество иммуноглобулинов, ФНОα, интерлейкин-6 и лектин DC-SIGN, который способствует проникновению ВИЧ в T-лимфоциты.
Кроме того наблюдается значительное снижение интерлейкина-2, вырабатываемого CD4-хелперами 1 типа и имеющего критическое значение в активации цитотоксических Т-лимфоцитов (CD8+, CTL) и подавление вирусом секреции макрофагами интерлейкина-12 — ключевого цитокина в образовании и активации T-хелперов 1 типа и NK-лимфоцитов (англ. Natural killer cells).
Антитела к ВИЧ По одним данным, у 99 % инфицированных, антитела обнаруживаются в течение первых 12 недель (6 — 12 недели) после первичного контакта с вирусом. По другим данным: у 90-95 % в течение 3-х месяцев после заражения, у 5-9 % — через 6 месяцев, 0,5-1 % — в более поздние сроки).
Период с ложноотрицательным результатом антител называется «периодом окна», в течение которого инфицированный человек уже может быть источником инфекции. Первыми выявляемыми антителами являются «gag» (англ. group antigen ) белки ВИЧ — р24 и р17, а также прекурсор р55. Образование анти-р24 антител сочетается со снижением уровней свободного р24 антигена, выявляемого в крови до появления антител.
Вслед за анти-р24 антителами появляются антитела против белков «Env» (англ. Envelope) — gp160, gp120, p88, gp41 и гена «pol» (англ. Polymerase) — p31, p51, p66.
Могут определяться также и антитела против генов «vpr», «vpu», «vif», «rev», «tat», «nef»[69][70].
Наиболее изученными антителами являются антитела направленные против «Env» белков — gp120, gp41. Они разделяются на два класса: тип-специфичные и групп-специфичные.
Другая группа анти-gp120 антител, участвующая в антител-зависимом цитотоксическом действии (англ. ADCC) и уничтожении инфицированных ВИЧ CD4+ клеток, может уничтожать и неинфицированные клетки, рецепторы которых связаны свободным gp120, циркулирующим в крови — эффект названный: Innocent bystanders (Bystander killing).
Диагностика иммунодефицитных состояний
При постановке диагноза врач, прежде всего, обращает внимание на семейный анамнез. Он выясняет, были ли в семье случаи аутоиммунных заболеваний, ранней смерти, раковых заболеваний в относительно молодом возрасте и так далее. Еще одним признаком ИДС может быть побочная реакция на вакцинацию.
После опроса доктор приступает к осмотру. Необходимо обращать внимание на внешний вид пациента. Как правило, человек, страдающий иммунодефицитом, имеет болезненный вид. У него бледная кожа, на которой часто имеются различного рода высыпания. Человек жалуется на постоянную слабость и переутомление.
Кроме этого у него могут быть воспалены глаза, наблюдаются хронические заболевания лор-органов, постоянный кашель, отеки ноздрей.
Для уточнения диагноза проводят дополнительное обследование, которое может включать в себя:
- анализ крови (общий, биохимический);
- анализ мочи;
- скриннинговые тесты;
- определения уровня иммуноглобулинов в крови и так далее.
Если выясняется, что у пациента имеется рецидивирующая инфекция, то принимаются меры к ее устранению. При необходимости возможен забор мазков с последующим исследованием их под микроскопом для выявления возбудителя инфекции.
Какую диагностику проходить
При подозрении на иммунодефицит обращаются к иммунологу. Происходит сбор анамнеза и общий осмотр для обнаружения видимых патологий и отклонений. Специалист назначает основную диагностическую процедуру — анализ крови. Два уровня оценки биоматериала, в каждом из которых подсчитывается количество определенных клеток, а также определяется ответ на внешние раздражители, говорит о наличии или отсутствии сбоев в работе иммунитета. Дополнительные исследования необходимы для установления точного диагноза:
- кожные пробы — проверка на заражение кандидами (при кожно-слизистом иммунодефиците);
- рентгеноскопия — исследование положения ребер (патологии характерны для дефицита некоторых ферментов);
- кардиограмма — аномалии развития сердца указывают на синдром Ди Джорджи.
Также используются генетические исследования для выявления дефектов в ДНК.
Лечение иммунодефицитных состояний
Иммунодефицитные состояния лечат при помощи антибактериальных, противовирусных, противогрибковых препаратов, а также иммуномодуляторов.
С учетом того, какое именно звено иммунной защиты было нарушено, могут быть назначены такие препараты, как интерферон, трава эхинацеи, Тактивин и так далее.
При инфицировании бактериями лечение иммунодефицитных состояний включает в себя прием антибактериальных препаратов широкого спектра действия в сочетании с иммуноглобулинами.
При вирусных заболеваниях показано назначение противовирусных средств (Валтрекс, Ацикловир и ряд других).
Обязательно назначается диета (с упором на белковую пищу), кислородные ванны, витаминотерапия. Показана физическая активность. В ряде случаев делают пересадку костного мозга.
Существуют препараты, которые необходимо обязательно использовать при слабом иммунитете. Они называются иммуномодуляторы. Пожалуй, самым известным и эффективным препаратом из данной группы является Трансфер Фактор.
Это мощнейший иммуномодулятор нового поколения, который при попадании в организм пациента оказывает следующее действие:
- быстро восстанавливает работу иммунной системы, нормализует обменные процессы;
- оказывает потенцирующее действие, усиливая терапевтический эффект от совместно принимаемых лекарственных средств;
- блокирует возможные побочные эффекты со стороны других препаратов;
- «запоминает» патогенные микроорганизмы и при их последующих попаданиях в организм дает сигнал на их немедленное уничтожение.
Трансфер Фактор — это на 100 % натуральный состав, поэтому он не дает побочных эффектов и практически не имеет противопоказаний.